Gadolínio, Gd, número atômico 64
Aeral
O gadolínio é um elemento químico com o elemento símbolo Gd e o número atômico 64. Na tabela periódica é no grupo dos lantanídeos e, portanto, também pertence aos metais das terras raras.
O primeiro elemento da Terra Ytterer na tabela periódica foi encontrado 1880 espectroscopicamente por Jean Charles Galissard de Marignac em didym e gadolinite. 1886 ele fez isso como um óxido branco de Samarskit e chamou Y de Samarskit. No mesmo ano, Paul Emile Lecoq de Boisbaudran também fabricado óxido de gadolínio e nomeou o novo elemento após o descobridor do gadolinita mineral, o químico finlandês Johan gadolínio, gadolínio.
Apenas 1935 conseguiu Georges Urbain a representação do metal.
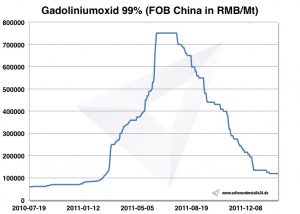
Claro, o gadolínio ocorre apenas em compostos. Tecnicamente importantes são Monazit e Bastnäsit. Os depósitos de gadolinita na Mina Ytterby, ao norte de Estocolmo, estão agora exaustos.
recuperação
Após uma separação complexa do outro Gadoliniumbegleiter, o óxido é reagido com fluoreto de hidrogênio para Gadoliniuimfluorid. Posteriormente, isso é reduzido com cálcio, com a formação de fluoreto de cálcio para o gadolínio metálico. A separação dos resíduos de cálcio remanescentes e impurezas ocorre em uma refusão adicional in vacuo.
Características
O metal de terras raras branco brilhante prateado a acinzentado branco é dúctil e maleável. Em temperaturas acima de 1508 K, o empacotamento esférico mais denso se transforma em uma estrutura cristalina centrada no corpo cúbico. No ar seco, o gadolínio é relativamente estável, no ar úmido, forma uma camada de óxido sem proteção, frouxamente aderente e peeling. Reage lentamente com a água. Em ácidos diluídos, dissolve-se.
Gadolínio tem com 49.000 celeiro devido ao seu isótopo continha Gd-157 (com 254.000 celeiro) a mais alta de neutrões térmico todos elementos estáveis conhecidos (somente a instável Xe excede 135 157 Gd cerca de um factor 10). A alta taxa de queima severa restringe severamente o uso como haste de controle em reatores nucleares.
Juntamente com disprósio, hólmio, érbio, térbio e que estão associados com o grupo de lantanídeos, assim, que é um dos elementos individuais - com a excepção de ferro, cobalto e níquel - são de um ferromagnetismo. No entanto, ele deve primeiro ser trazido abaixo de sua temperatura ferromagnética Curie de 292,5 K (19,3 ° C). [6]
Ao contrário de muitas referências, o gadolínio não é supercondutor. Isso também é baseado na experiência de que a contaminação de substâncias ferromagnéticas, como ferro e gadolínio, destrói a supercondutividade de outros elementos. mas não são conhecidos os supercondutores cerâmicos de alta temperatura do tipo Ba2GdCu3O7-X possuindo uma temperatura de transição entre 80 85-K.
Poeiras de gadolínio metálico são perigosas para o fogo e explosivos.
Usar
O gadolínio é usado para fazer gadolínio de granada de ítrio para aplicações de microondas. Os oxissulfuretos são usados para produzir fósforo verde para telas luminescentes (radar).
Os compostos de gadolínio (III) intravenosamente injetados, como o gadopentetato de dimeglumina, atuam como agentes de contraste nos exames de ressonância magnética. Para esta finalidade, tais como os quelatos de DTPA (ácido dietilenotriaminopentaacético) e DOTA (ácido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetra-acético, com Gd = gadotérico) é usado por causa da elevada toxicidade dos iões gadolínio livre de complexação com alta complexação. Devido aos sete elétrons desemparelhados na f shell, o gadolínio é altamente paramagnético. O agente de contraste permite assim que os protões circundantes - essencialmente a água - relaxem mais rapidamente. Isso aumenta significativamente as diferenças de contraste entre diferentes tecidos em uma ressonância magnética.
Mesmo para estudos sobre o cérebro, estes agentes de contraste pode ser utilizado porque os complexos de gadolínio não atravessam a barreira sangue-cérebro em doentes saudáveis e, portanto, uma barreira de ruptura sangue-cérebro - uma referência a um eventos patológicos (por exemplo, isquemia, tumor, inflamação) - tornar visível.
A granada de gálio gadolínio foi usada para fazer reservas de bolhas magnéticas. Também é usado na produção de discos compactos regraváveis.
Adições de 1% gadolínio aumentam a usinabilidade e a alta temperatura e resistência à oxidação de ligas de ferro e cromo. Ligas de cobalto de ferro de gadolínio correspondentes podem ser usadas para armazenamento de dados optomagnéticos.
O gadolínio, por apresentar um ponto Curie próximo à temperatura ambiente, pode ser utilizado em resfriadores que operam com base no princípio da magnetização adiabática. Esses refrigeradores dispensariam a camada de ozônio que danifica os clorofluorcarbonos (CFCs) e não estariam sujeitos a partes de danos mecânicos.
O gadolínio é utilizado na forma de óxido de gadolínio em conjuntos modernos de combustível como material absorvedor de calor que, após uma mudança de combustível no início do ciclo de operação, limita o excesso de reatividade do reator devido a um excesso de combustível nuclear. Quando o combustível queima, o gadolínio também é degradado. [7]
O oxissulfeto de gadolínio dopado com térbio (Gd2O2S: Tb) é um cintilador comumente usado em tecnologia de raios-X. Gd2O2S: Tb emite luz com um comprimento de onda de 545nm.
Não há função biológica conhecida do gadolínio.
Íons de gadolínio livres se comportam de maneira semelhante aos íons de cálcio, ou seja, são incorporados principalmente no fígado e no sistema ósseo e podem permanecer lá por anos. gadolínio livre também afectada como um antagonista do cálcio - o raio iónico de cálcio e gadolínio são quase a mesma - a contractilidade do miocárdio e inibir o sistema de coagulação [9].
Soluções intravenosamente aplicadas de íons gadolínio livres são extremamente tóxicas. A toxicidade afeta os músculos lisos e estriados, a função mitocondrial e a coagulação sanguínea. [10]
A toxicidade do gadolínio livre é considerada alta. Na forma complexada, como o gadolínio nos meios de contraste aprovados, é geralmente bem tolerado considerando as contraindicações. Desde 2006 há cada vez mais relatos de que podem ocorrer em pacientes com insuficiência renal em vários quelatos de gadolínio, especialmente Gd-DTPA, o quadro clínico de fibrose sistêmica nefrogênica.
| Geral | |
| Nome, símbolo
ordinal |
Gadolínio, Gd, 64 |
| série | lantanídeos |
| Grupo, período, bloco | La, 6, f |
| Aparência | branco prateado |
| número CAS | 7440-54-2 |
| Fração de massa do envelope da terra | 5,9 ppm |
| nuclear | |
| massa atômica | 157,25 u |
| raio atômico | 188 pm |
| Raio covalente | 196 pm |
| Elektronenkonf. | [Xe] 4f (7) 5d (1) 6s2 |
| 1. ionização | 593,4 KJ / mol |
| 2. ionização | 1170 KJ / mol |
| 3. ionização | 1990 KJ / mol |
| fisicamente | |
| estado físico | fest |
| estrutura de cristal | hexagonal |
| densidade | 7,886 g / cm3 (25 ° C) |
| magnetismo | paramagnético (χm = 0,12) |
| ponto de fusão | 1585 K (1312 C) |
| ponto de ebulição | 3523 K (3250 C) |
| Volume molar | 19,90 * 10 (-6) m (3) / mol |
| Calor de vaporização | 305 KJ / mol |
| calor de fusão | 10,0 KJ / mol |
| Condutividade elétrica | 0,763 * 10 (6) A / (V * m) |
| condutividade térmica | 11 W / (m * K) |