Gálio, Ga, número atômico 31
Gálio - preço do gálio, ocorrência, extração, uso
Geral
Gálio é um elemento químico que ocorre raramente com o símbolo de elemento Ga e o número atômico 31. Na tabela periódica ele está no 4º período e é o terceiro elemento do 3º grupo principal (grupo 13) ou grupo de boro. É um metal branco prateado fácil de liquefazer. O gálio não cristaliza em uma das estruturas cristalinas que normalmente são encontradas em metais, mas em sua modificação mais estável em uma estrutura ortorrômbica com dímeros de gálio. Além disso, são conhecidas seis outras modificações que se formam sob condições especiais de cristalização ou sob alta pressão. Em termos de propriedades químicas, o metal é muito semelhante ao alumínio.
Na natureza, o gálio ocorre apenas em pequena extensão e principalmente como uma mistura em minérios de alumínio, zinco ou germânio; Os minerais de gálio são muito raros. Consequentemente, também é obtido como subproduto na produção de alumínio ou zinco. A maior parte do gálio é processada no arsenieto de gálio semicondutor, que é usado principalmente para diodos emissores de luz.
ocorrência
O gálio é um elemento raro na terra, com um teor de 19 ppm na crosta continental, sua abundância é comparável à do lítio e do chumbo. Não ocorre na forma elementar, mas apenas na forma ligada, principalmente em minérios de alumínio, zinco ou germânio. Os minérios mais ricos em Gálio incluem bauxita, minérios de zinco-blenda e germanita.
Os teores de gálio são em sua maioria baixos; a bauxita encontrada no Suriname com o maior teor conhecido contém apenas 0,008% de gálio. As reservas de gálio na bauxita em todo o mundo são 1,6 · 106 Toneladas estimadas. Teores mais altos de até 1% de gálio ocorrem na germanita. Apenas na mina Apex, no estado americano de Utah, os minérios encontrados são tão elevados que se tentou minerar o gálio. No entanto, isso falhou depois de um curto período de tempo por razões de lucratividade.
Apenas alguns minerais de gálio são conhecidos, incluindo a galita (CuGaS2), Söhngeit (Ga (OH)3) e tsumgallite (GaO (OH)).
Extração e apresentação
O gálio é obtido como subproduto da produção de alumínio a partir da bauxita no processo Bayer. A mistura de aluminato de sódio e galato de sódio dissolvidos em solução de hidróxido de sódio serve como produto de partida. O gálio pode ser separado do alumínio por meio de vários processos. Uma possibilidade é a cristalização fracionada com o auxílio de dióxido de carbono, com o hidróxido de alumínio precipitando inicialmente preferencialmente, enquanto o galato de sódio mais solúvel se acumula na solução de hidróxido de sódio. O hidróxido de gálio só é precipitado após outras etapas do processo, misturado com hidróxido de alumínio. A mistura é então dissolvida em solução de hidróxido de sódio e o gálio é obtido por eletrólise. Por ser um processo intensivo em energia e mão de obra, ele só é utilizado em países de baixo custo, como a República Popular da China.
O gálio também pode ser obtido diretamente da solução de hidróxido de sódio por eletrólise. Catodos de mercúrio são usados para este propósito, um amálgama de gálio sendo formado durante a eletrólise. Também é possível adicionar amálgama de sódio à solução.
Com a ajuda de hidroxiquinolinas especiais como ligantes quelantes, é possível extrair o gálio da soda cáustica com querosene e, assim, separá-lo do alumínio. Outros elementos, também extraídos, podem ser separados com ácidos diluídos. O composto de gálio restante é então dissolvido em ácido clorídrico ou sulfúrico concentrado e reduzido eletroliticamente ao metal.
O gálio muito puro é necessário para muitas aplicações técnicas; para semicondutores, por exemplo, pode conter apenas um centésimo milionésimo de substâncias estranhas. Os métodos de limpeza possíveis são destilação a vácuo, cristalização fracionada ou fusão por zona.
A quantidade de gálio produzida é pequena, em 2008 a produção primária mundial foi de 95 toneladas. Outra fonte importante é a reciclagem de resíduos contendo gálio, de onde foram extraídas 2008 toneladas de gálio em 135. Os principais países produtores são a República Popular da China, Alemanha, Cazaquistão e Ucrânia, e os Estados Unidos, Japão e Reino Unido para a reciclagem de gálio.
Em uma escala de laboratório, o gálio pode ser produzido por eletrólise de uma solução de hidróxido de gálio em solução de hidróxido de sódio em eletrodos de platina ou tungstênio.
Propriedades
Propriedades físicas
O gálio é um metal macio, branco prateado (dureza de Mohs: 1,5). Tem um ponto de fusão anormalmente baixo para metais, que é 29,76 ° C. Depois do mercúrio e do césio, é o metal com o ponto de fusão mais baixo, que também está bem abaixo dos elementos vizinhos alumínio e índio. Isso provavelmente se deve à estrutura cristalina incomum, que, ao contrário das estruturas de outros metais, não tem um alto grau de simetria e, portanto, não é muito estável. Como o ponto de ebulição é comparativamente alto a 2204 ° C, o gálio tem uma área incomumente grande na qual é líquido. Devido à difícil cristalização, o gálio líquido pode ser facilmente resfriado abaixo do ponto de fusão (sub-resfriamento) e cristaliza repentinamente quando os núcleos de cristalização se formam.
Assim como o silício, alguns outros elementos e a água, o gálio tem uma anomalia de densidade, sua densidade no estado líquido é cerca de 3,2% maior do que na forma sólida. Isso é típico de substâncias que possuem ligações moleculares no estado sólido.
O gálio é diamagnético no estado sólido, mas torna-se paramagnético no estado líquido ( = 2,4 10-6 a 40 ° C)
= 2,4 10-6 a 40 ° C)
A formação de ligações gálio-gálio é característica de suas estruturas. São conhecidas várias modificações que se formam sob diferentes condições de cristalização (quatro modificações conhecidas, α- a δ-gálio, sob pressão normal) e sob pressão (um total de três outras modificações de alta pressão, Ga-II, Ga-III, Ga-IV). A modificação mais estável à temperatura ambiente é o α-gálio, que se cristaliza em uma estrutura de camada ortorrômbica. Dois átomos ligados um ao outro por meio de uma ligação covalente formam um dímero. Cada átomo de gálio também é adjacente a seis outros átomos de outros dímeros. Existem ligações metálicas entre os dímeros individuais. Os dímeros de gálio são tão estáveis que inicialmente são retidos mesmo quando derretem e também podem ser detectados na fase gasosa.
Outras modificações são formadas durante a cristalização do gálio líquido super-resfriado. A −16,3 ° C, forma-se o β-gálio, que possui uma estrutura cristalina monoclínica. Na estrutura existem cadeias em ziguezague paralelas de átomos de gálio. Se a cristalização ocorrer a uma temperatura de −19,4 ° C, forma-se o δ-gálio trigonal, no qual, comparável ao α-boro, existem icosaedros distorcidos compostos de doze átomos de gálio. Eles estão conectados uns aos outros por meio de átomos de gálio individuais. A −35,6 ° C, o γ-gálio é finalmente formado. Nesta modificação ortorrômbica, os tubos são formados a partir de Ga interconectados7Anéis no meio de uma cadeia linear de outros átomos de gálio.
Se o gálio for colocado sob alta pressão em temperatura ambiente, várias modificações de alta pressão serão formadas uma após a outra quando a pressão for aumentada. A modificação cúbica do gálio-II é estável acima de 30 kbar, em que cada átomo é circundado por mais oito. Se a pressão for aumentada para 140 kbar, o metal agora se cristaliza como gálio-III tetragonal em uma estrutura que corresponde à do índio. Se a pressão for aumentada ainda mais para cerca de 1200 kbar, a estrutura cúbica de gálio IV centrada na face é finalmente formada.
Propriedades químicas
As propriedades químicas do gálio são semelhantes às do alumínio. Assim, o gálio é passivado pela formação de uma densa camada de óxido no ar e não reage. Somente em oxigênio puro em alta pressão o metal queima com uma chama brilhante para formar o óxido. Da mesma forma, também não reage com a água, uma vez que aqui se forma o hidróxido de gálio insolúvel. Por outro lado, se o gálio é ligado ao alumínio e é líquido à temperatura ambiente devido à redução do ponto de fusão, ele reage de forma muito violenta com a água. Gálio também reage rapidamente com halogênios para formar os sais correspondentes GaX3.
O gálio é anfotérico e solúvel em ácidos e bases com evolução de hidrogênio. Em ácidos, como o alumínio, os sais com Ga são formados3+Íons, em bases de galatos da forma [Ga (OH)4]-. Dissolve-se lentamente em ácidos diluídos e rapidamente em água régia e soda cáustica concentrada. O gálio é passivado pelo ácido nítrico.
![\ mathrm {2 \ NaOH + 2 \ Ga + 6 \ H_2O \ rightarrow 2 \ Na [Ga (OH) _4] + 3 \ H_2 \ uparrow}](https://upload.wikimedia.org/wikipedia/de/math/7/e/6/7e633a1c6ed8f76b3ebfabbcaba5e544.png)
- Reação de gálio com soda cáustica
A maioria dos metais é atacada pelo gálio líquido, portanto, ele só pode ser armazenado em recipientes de quartzo, vidro, grafite, óxido de alumínio, tungstênio até 800 ° C e tântalo até 450 ° C.
isótopo
Há um total de 30 isótopos de gálio entre 56Ga e 86Ga e outros sete isômeros de núcleo são conhecidos. Destes são dois 69Ga e 71Ga estável e também ocorrem na natureza. Na composição isotópica natural predomina 69Ga com 60,12%, 39,88% são 71Ga. Dos isótopos instáveis 67Ga tem a meia-vida mais longa com 3,26 dias, as outras meias-vidas variam de segundos a um máximo de 14,1 horas 72Ga.
Dois isótopos de gálio 67Ga e o de curta duração com meia-vida de 67,71 minutos 68Os Ga são usados na medicina nuclear como marcadores para tomografia por emissão de pósitrons. 67Ga é produzido em um ciclotron, enquanto na produção de 68Nenhum ciclotron é necessário. Em vez disso, o isótopo de germânio de vida mais longa 68Ge por irradiação de 69Ga gerado com prótons. Isso desmorona 68Ga, o resultado 68Ga pode ser extraído em um gerador de gálio-68. Para estudos, o gálio é geralmente ligado a um complexo com um ligante fortemente quelante, como o ácido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacético (DOTA).
Usar
Devido à raridade do elemento, o gálio é usado apenas de forma limitada. Vários compostos de gálio são feitos da maior parte do gálio produzido. De longe, os mais importantes economicamente são aqueles com elementos do 5º grupo principal, sobretudo o arseneto de gálio, necessário para células solares e diodos emissores de luz, entre outras coisas. Em 2003, 95% do gálio produzido foi utilizado para esse fim. Também serve como material para dopagem de silício (p-dopagem).
A grande faixa de temperatura em que o elemento é líquido e a baixa pressão de vapor ao mesmo tempo são utilizadas para a construção de termômetros. Termômetros de gálio podem ser usados em temperaturas de até 1200 ° C. O gálio líquido pode ser usado como um líquido de barreira para medir o volume de gases em temperaturas mais altas e como um material de eletrodo líquido na extração de metais ultra-puros, como o índio.
O gálio tem alta molhabilidade e boa refletividade e, portanto, é usado como revestimento de espelhos. Também é usado em ligas fundidas, para trocadores de calor em reatores nucleares e como substituto do mercúrio em lâmpadas.
As ligas de gálio com outros metais têm vários usos. Os materiais magnéticos são criados pela liga com gadolínio, ferro, ítrio, lítio e magnésio. A liga com vanádio na composição V3Ga é um supercondutor com uma temperatura de transição comparativamente alta de 16,8 K. Em armas nucleares, é ligado ao plutônio para evitar mudanças de fase. Muitas ligas de gálio, como Galinstan, são líquidas à temperatura ambiente e podem substituir o mercúrio tóxico ou as ligas de sódio-potássio muito reativas.
prova
O gálio pode ser detectado qualitativamente com várias reações de cor típicas. Estes incluem a reação com rodamina B em benzeno, que fluoresce laranja-amarelo a vermelho-violeta quando o gálio é adicionado, morina, que mostra fluorescência verde como na reação com alumínio, e hexacianidoferrato de potássio (III), com o gálio um precipitado branco de hexacianidoferrato de gálio (III ) formulários. Além disso, uma detecção espectroscópica é possível através das linhas espectrais violeta características em 417,1 e 403,1 nm.
A evidência quantitativa pode ser fornecida por meio de titulações complexométricas, por exemplo, com ácido etilenodiaminotetracético ou por meio de espectrometria de absorção atômica.
Toxicologia e significado biológico
Não existem dados toxicológicos para o gálio metálico; no entanto, é corrosivo para a pele e as membranas mucosas. Os compostos nitrato de gálio (III) Ga (NO3)3 e óxido de gálio (III) Ga2O3 possuir LD oral50Valores na faixa de gramas: 4,360 g / kg para o nitrato e 10 g / kg para o óxido. O gálio é, portanto, considerado de baixa toxicidade e, até onde se sabe, não desempenha nenhum papel em humanos como oligoelemento.
Conexões
Em compostos, o gálio ocorre quase exclusivamente no estado de oxidação +3. Além disso, compostos de gálio (I) raros e geralmente muito instáveis são conhecidos, bem como aqueles que contêm gálio mono- e trivalente (formalmente compostos de gálio (II)).
Compostos com elementos do grupo nitrogênio
Os compostos de gálio tecnicamente mais importantes são aqueles com os elementos do grupo nitrogênio. Nitreto de gálio, fosfeto de gálio, arseneto de gálio e antimoneto de gálio são semicondutores típicos (semicondutores III-V) e são usados para transistores, diodos e outros componentes eletrônicos. Em particular, diodos emissores de luz de várias cores são produzidos como compostos de grupos de gálio e nitrogênio. A cor, que depende do gap, pode ser ajustada por diferentes proporções de ânions ou substituindo o gálio por alumínio ou índio. O arsenieto de gálio também é usado para células solares. Eles são usados em satélites em particular, pois o arsenieto de gálio é mais resistente à radiação ionizante do que o silício.
halogenetos
Haletos de gálio da forma GaX3 são semelhantes em muitas propriedades aos compostos de alumínio correspondentes. Com exceção do fluoreto de gálio (III), eles ocorrem como dímeros em uma estrutura de brometo de alumínio. O cloreto de gálio (III) é o único haleto de pouca importância econômica. É usado como um ácido de Lewis em reações de Friedel-Crafts.
Conexões adicionais
Como o óxido de alumínio, o óxido de gálio (III) é um sólido incolor de alto ponto de fusão. Ela ocorre em cinco modificações diferentes, das quais a modificação β cúbica é a mais estável.
Compostos orgânicos de gálio existem como Gallane GAR3, Gallylene GAR e como gallans superioresque contêm ligações gálio-gálio. Como muitos outros compostos organometálicos, eles são instáveis ao ar e à hidrólise. Um dos poucos compostos orgânicos de gálio de importância econômica é o trimetilgálio, que é usado como reagente dopante e para a produção de finas camadas de arseneto de gálio e nitreto de gálio em epitaxi organometálico de fase gasosa.
| Geral | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome, símbolo, número atômico | Gálio, Ga, 31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| série | metais | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 13, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | branco prateado | ||||||||||||||||||||||||||||||||||||||||||||||||
| número CAS | 7440-55-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Fração de massa da concha de terra | 14 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||
| nuclear | |||||||||||||||||||||||||||||||||||||||||||||||||
| massa atômica | 69,723 u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico (calculado) | 130 (136) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 187 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| configuração electrónica | [Ar] 3d10 4s2 4p1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionização | 578,8 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionização | 1979,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionização | 2963 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| fisicamente | |||||||||||||||||||||||||||||||||||||||||||||||||
| estado físico | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| modificações | sete | ||||||||||||||||||||||||||||||||||||||||||||||||
| densidade | 5,904 g / cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| dureza de Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | diamagnético ( = -2,3 10-5) = -2,3 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| ponto de fusão | 302,91 K (29,76 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ponto de ebulição | 2477 K (2204 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molar | 11,80 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 256 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| calor de fusão | 5,59 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| velocidade do som | 2740 m / s em 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade de calor específico | 371 J / (kg K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade elétrica | sobre 7,14 · 106 A / (v · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
| condutividade térmica | 29 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Químico | |||||||||||||||||||||||||||||||||||||||||||||||||
| estados de oxidação | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| potencial normais | -0,53 V (Ga3+ + 3 e- † 'Ga) | ||||||||||||||||||||||||||||||||||||||||||||||||
| eletronegatividade | 1,81 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| isótopo | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| segurança | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
 |
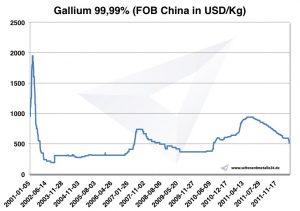
Chart Gálio 2001-2011
Preços do gálio -> Preços do gálio a preços para metais estratégicos
