Antimônio, Sb, número atômico 51
Preço de antimônio, histórico, ocorrência, extração e uso
antimônio
Antimónio (do latim Antimonium, presumivelmente por arábica "al-ithmid (un)" é um elemento químico com o elemento de símbolo de Sb (do latim Stibium, (cinzento) de antimónio ') e o número ordinal 51. Na tabela periódica, é no 5. Período e grupo principal 5, ou grupo 15, grupo IUPAC ou grupo de nitrogênio Na modificação estável, é um semi-metal prata-brilhante e quebradiço.
Nome, história
Acredita-se também que o nome remonta ao falecido anthem grego (bloom alemão). O objetivo era descrever os cristais de sulfeto de antimônio, semelhantes a pedúnculos, que apareciam como tufos de flores e pareciam flores. No 11. Século encontra-se o termo latino para o medicamento antimonium da medicina mineral para a terapia interna de doenças, em seguida, com Constantinus Africanus.
No 17. No século 19, o nome antimônio foi usado para se referir ao metal. O termo copta para o sulfato de antimônio de pó de maquilagem passou sobre o grego no stibium latino. A abreviatura Sb usada pelo médico e químico sueco Jöns Jakob Berzelius ("pai da química moderna") ainda é usada hoje como um símbolo de elemento.
Uma lendária etimologia folclórica lendária imortalizada por Samuel Johnson em seu dicionário diz que o monge alemão Basilius Valentinus observou que os porcos rapidamente engordavam ao absorver o antimônio. Ele também tentou isto em seus frades, ao que eles morreram, entretanto, para que o termo "antimoine" (antimônio) fosse cunhado, a partir do qual mais tarde "antimônio" foi criado.
Uma localidade típica para o antimônio sólido é a mina de prata no município sueco de Sala, em Västmanland. No entanto, o antimônio metálico já era conhecido pelos chineses e babilônios. Alguns de seus compostos já eram usados na Idade do Bronze como um suplemento ao cobre para produzir bronze (descobertas de Velem St. Vid na Hungria).
ocorrência
O antimônio é um elemento raro. Uma vez que também pode ser encontrada na natureza (ou seja, na forma elementar), é certificada pela Associação Mineralógica Internacional (IMA) sob o sistema não. 1.CA.05 reconhecido como um mineral.
O antimônio sólido (2011) foi detectado em todo o mundo nos sites da 300. Assim, inter alia, em várias regiões da Austrália; nos departamentos bolivianos de La Paz e Potosí; Minas Gerais no Brasil; Floresta Negra, Fichtelgebirge, Floresta do Alto Palatinado, Odenwald e Harz na Alemanha; Seinäjoki na Finlândia; várias regiões da França; Lombardia, Piemonte, Sardenha e Trentino Alto Adige, na Itália; algumas regiões do Canadá; algumas regiões da Áustria; Sibéria Oriental e Ocidental e os Urais na Rússia; além de Västmanland, Dalarna, Gästrikland, Närke, Södermanland, Värmland e Västerbotten, na Suécia; em algumas regiões da Eslováquia; Bohemia e Moravia na República Checa, bem como em muitas regiões dos EUA. Um dos depósitos mais importantes do mundo de minérios sólidos de antimônio e antimônio é o greenstone belt Murchison, na região de Murchison, na África do Sul.
Até agora os minerais de antimônio 264 são conhecidos (a partir de: 2010). o mineral de sulfureto Stibnit Sb2S3 é utilizado industrialmente principalmente (antimónio cinzento) com um teor de no máximo 71,7% Sb. O mineral com o mais alto teor de Sb em um composto químico é a liga de antimónio-arsénio natural, Paradocrasit (máx. 92%). No entanto, ele vem com apenas três localidades, em contraste com o Stibnit (em torno dos sites 2500), muito menos comum. Outras fontes de antimônio são os minerais Valentinit Sb2O3 (antimônio branco), Breithauptit NISB (níquel antimônio, Nickelantimonid) Kermesit Sb2S2O (Rotspießglanz) e Sb2S5 (enxofre Gold).
Extração e apresentação
Tecnicamente, o antimônio é extraído do brilho de antimônio. Um método é baseado na torrefação e redução com carbono (método de redução redutiva):
Outra possibilidade é realizar a redução com ferro (método de precipitação):
Em todo o mundo estavam no início do 21. Século entre 110.000 e 160.000 toneladas por ano de antimônio promovido. Desde o 1900, a saída aumentou mais de dez vezes.
87% da produção de antimônio ocorre na China (a partir de: 2015).
Propriedades
O antimônio pode ocorrer em três diferentes modificações, sendo o antimônio metálico ou cinza a modificação mais consistente.
Sob condições normais, antimónio cristalizado trigonal em romboédrica da maneira descrita pelo grupo espacial notação Hermann-Mauguin R3m (sem. 166) com os parâmetros de rede a = C = 431 pm e pm e seis unidades de fórmula 1127 por célula unitária.
Ao extinguir o vapor de antimônio em superfícies frias, formou-se antimônio amorfo, preto e altamente reativo, que é convertido novamente em antimônio metálico por aquecimento. A produção eletrolítica produz explosivos de antimônio que, quando rachados, se tornam explosivamente brilhantes e se acendem em antimônio metálico. No entanto, esta forma contém sempre algum cloro e não pode ser considerada uma modificação. Antimônio amarelo também não é uma modificação independente, mas um composto químico altamente polimérico com hidrogênio.
Propriedades físicas
O antimônio metálico é branco-prateado, muito brilhante, escamoso-grosseiramente cristalino. É fácil esmagar devido à sua fragilidade. A condutividade elétrica e térmica é baixa.
Propriedades químicas
Com hidrogênio nascente, o antimônio reage com o hidreto de antimônio instável SbH3. O ar e a água não atacam o antimônio à temperatura ambiente. Acima do ponto de fusão, ele queima no ar com uma chama branco-azulada para o óxido de antimônio (III). Dissolve-se em ácidos minerais concentrados quentes. Com os halogéneos, reage vigorosamente à temperatura ambiente aos halogenetos correspondentes.
Nos compostos, o antimônio está presente principalmente nos estados de oxidação + 3 e + 5. Em antimonídeos de metal, como o antimonido de potássio K3Sb, forma os íons Sb3.
isótopo
Existem dois isótopos de antimônio estáveis: 121Sb e 123Sb.
Uso e ligas
A maioria do antimônio produzido é processado em ligas e mostra as seguintes propriedades:
Serve para endurecer chumbo e ligas de estanho. Em contraste com a maioria dos outros metais, ele se expande com o resfriamento do fundido (devido à conversão para outra modificação): o teor de antimônio pode ser ajustado de modo que tais ligas não encolham em encolhimento ou mesmo se expandam um pouco; Quando as peças são produzidas em moldes de fundição, as prensas de metal durante a solidificação em todos os cantos e ângulos, de modo que até mesmo formas complicadas e superfícies fortemente modeladas podem ser feitas livres de vazios.
Ligas importantes:
- Ligas de chumbo-antimônio: chumbo duro, metal carta, metal de rolamento, chumbo do acumulador, bainha de chumbo para cabos subterrâneos
- Ligas de estanho-antimônio: Britannia metal, metal de rolamento
- Produção de semicondutores, por exemplo. B. por dopagem de silício, para a produção de semicondutores compostos III V
- Ligas de estanho-antimônio-cobre (Babbit metal) para metais portantes
- Ligas de estanho-antimônio-cobre-chumbo para estanho e outros artigos de estanho
a chamada solda ou solda macia - Antimônio de alumínio, antimônio de gálio, antimônio de índio para infravermelho e dispositivos de efeito Hall
- Ligas de antimônio sem encolhimento para fundição de precisão
Medicina
O antimônio (ou uma preparação derivada do minério de antimônio) estava no 16. e 17. Tornou-se um "medicamento principal" (iatroquímico), mas foi - como outras drogas paracelsianas - controversa e também proibida na França entre 1615 e 1688.
A pedra tártara tem sido usada há muito tempo como agente de refração (pílula de antimônio), e hoje ainda é usada para estudar o conteúdo estomacal das aves.
Tanto a esquistossomose quanto os tripanossomos estavam começando no início do 19. Século com Brechweinstein (Kaliumantimonyltartrat) lutou. A pedra tártara era feita armazenando vinho em um copo de antimônio por um dia e depois bebendo. Enquanto isso, drogas mais eficazes e mais compatíveis são usadas.
Suplementos de antimônio são comumente usados como formas pentavalentes menos tóxicas para terapia medicamentosa de leishmaniose e esquistossomose, mas não são mais a droga de primeira escolha em países desenvolvidos. O antimônio inibe a enzima fosfofrutoquinase, que é a etapa limitante da taxa na glicólise.
mais
- Jogo de kindling
- Parte de explosivos detonadores e munição com chumbo.
- Trissulfeto de antimônio em lonas de freio de veículos
Antimônio (V) de sulfureto de: - para a produção (vulcanização) de borracha vermelha (exemplo: mangueiras de borracha de laboratório)
- como um componente vermelho da cabeça de tiro em jogos
- mais cedo que maquiagem de olho e em oftalmologia ("Augenerweiterer")
- Cromato de antimônio como pigmento de cor amarela
óxidos de antimónio - Catalisador para a produção de poliéster e PET (óxido de antimônio (III))
- como pigmento branco para colorir poliestireno, polietileno e polipropileno
- Produção de esmaltes brancos e fritas (porcelana)
- Purificação de vidro com chumbo
- dopado com estanho como um revestimento condutor transparente (óxidos de antimônio-estanho "ATO"), por exemplo em vidros, para a produção de displays ou em pigmentos eletricamente condutivos ("Minatec"), para revestimentos para dissipar cargas eletrostáticas.
- em pigmentos ("Lazerflair") para a marcação a laser de peças de plástico, devido à forte absorção do laser de marcação usual da radiação infravermelha (Nd: YAG).
- em camuflagem por causa da forte absorção de infravermelho.
- como retardador de chama e como componente de tintas resistentes a chamas e retardantes de chama,
- Plásticos e têxteis para revestimento de cabos, tampas de assento de carro, tecidos para cortinas, roupas infantis e muito mais. Ä.
- Sais de antimônio como componente de pesticidas, manchas e fogos de artifício
- Divisor de ouro: para a precipitação de prata do ouro derreter
toxicidade
O antimonial pode ser fatal na ingestão de 200 para 1200 mg. Em toxicologia, são conhecidas três formas de antimônio, das quais o hidreto de antimônio gasoso (Stiban, SbH3) é a forma mais perigosa que induz a hemólise maciça. Após toxicidade, o tártaro emético segue com antimônio trivalente ("trivalente"), enquanto o antimônio pentavalente é o menos tóxico.
O antimónio trivalente é absorvido nos glóbulos vermelhos nas primeiras duas horas após a ingestão para 95% e, portanto, enriquecido principalmente em órgãos fortemente perfundidos. A excreção é predominantemente devida à ligação à glutationa através da bile com uma circulação entero-hepática correspondentemente alta, e apenas uma pequena parte é eliminada pelos rins. O antimonil tartarato de potássio é excretado a 90% no primeiro dia após a ingestão, sendo o restante 10% devido a uma cinética de eliminação mais lenta ao longo dos dias 16.
Acredita-se que o antimônio, como o arsênico, inibe a função do complexo piruvato desidrogenase, levando a uma deficiência do adenosina trifosfato transportador de energia intracelular (ATP). Isto conduz à formação de complexos quelatos entre os grupos antimónio e tiol das enzimas correspondentes. No corpo, é tóxico em muitos órgãos, incluindo o trato digestivo, fígado, rins, coração e sistema nervoso central. A concentração mais alta consegue o antimônio no fígado, onde pode vir a uma hepatite até a insuficiência hepática. No coração há alterações no ECG com inversão e redução da onda T e prolongamento do intervalo QT. Insuficiência renal aguda pode levar a hemodiálise temporária ou permanente.
é feito terapeuticamente num envenenamento antimónio além de medidas de suporte, tais como a terapia de infusão (tanto para compensar a perda de fluido através de vómitos e para proteger os rins), e o controlo frequente de sinais vitais e ECG, a administração de carvão activado, N-acetil cisteína como um precursor de glutationa para aumento da secreção e um agente quelante, por ex. B. Dimercaprol.
Os resultados da pesquisa indicam que os compostos de antimônio irritam a pele e as membranas mucosas. Estes compostos provavelmente se dissolvem de plástico e têxteis.
Instruções de segurança e valores limite
Dos compostos de antimónio, a UE classificou o fluoreto de antimónio como tóxico (T) e os cloretos como corrosivos (C) e como perigosos para o ambiente (N); todos os outros compostos de antimônio como prejudiciais (Xn) e perigosos para o meio ambiente (N). Antimônio em si não está listado lá, de acordo com a ficha de dados de segurança, é rotulado como irritante.
A Agência Internacional de Pesquisa sobre o Câncer (IARC) classifica o óxido de antimônio (III) como uma possível substância carcinogênica.
Na UE, a água potável tem um limite de 5 μg / l. Exames de suco de frutas engarrafados em garrafas PET (para os quais não há diretrizes) revelaram concentrações de antimônio de até 44,7 μg / L em concentrados de suco não diluídos.
O antimónio foi adicionado à 2016 pela UE ao abrigo do Regulamento (CE) n.º 1907 / 2006 (REACH) no contexto da avaliação de substâncias no plano de acção comunitário continuado (CoRAP). Reavaliará o impacto da substância na saúde humana ou no ambiente e, quando apropriado, iniciará o seguimento. As principais razões para a aceitação do antimônio foram preocupações com a exposição dos trabalhadores, alta (agregada) tonelagem, alto risco (RCR) e uso generalizado, bem como o risco potencial de propriedades cancerígenas. A reavaliação é executada desde 2018 e é realizada pela Alemanha.
prova
testes preliminares:
Coloração da chama: Chama azul pálido, pouca característica Phosphorsalzperle: Incolor (perturbado por todos os elementos que produzem uma pérola colorida)
reacção de detecção:
Redução por metais básicos, por exemplo, ferro, zinco ou estanho.
Em soluções não ácidas, os metais básicos reduzem os cátions antimônio Sb (III), Sb (V) e Sb (III) / (V) ao antimônio metálico:
2 Sb3 + + 3 Fe → 2 Sb + 3 Fe2 +
A substância a testar para o antimónio é colocada em solução de ácido clorídrico e misturada com pó de ferro. O resultado é um precipitado preto e escamoso de antimônio metálico na solução ou diretamente no ferro. A prova de uma unha de ferro também é possível. Aqui, um depósito preto na unha é uma prova de antimônio, que foi depositado aqui elementarmente.
A amostra Marsh permite uma detecção clara de antimônio. Quando a substância piroliticamente depositada (espelho escuro e brilhante) não se dissolve no peróxido de hidrogênio amoniacal, o arsênico e o germânio são excluídos como possíveis alternativas.
A determinação altamente sensível de pequenos traços de antimônio ocorre através da técnica de hidreto de espectrometria atômica. Em princípio, a amostra de Marsh é acoplada à espectrometria de absorção atômica. Os efeitos de matriz da solução de amostra podem ser suprimidos de forma muito eficaz.
Outro método é tratar uma solução aquosa contendo íons antimônio com solução de rodamina B. Forma um complexo colorido que pode ser extraído com éter isopropílico. No entanto, esta evidência é bastante inespecífica, uma vez que os íons ouro, cádmio, gálio, tálio, urânio e tungstênio formam complexos coloridos.
Conexões
- Antimônio hidrogênio, também chamado de monostibano SbH3.
- Gás tóxico que é formado a partir de antimônio e ácidos.
- Distiban (Sb2H4)
compostos halogenados
- O fluoreto de antimônio (V) (SbF5) forma (de acordo com o VSEPR) uma pirâmide quadrada e hibrida com sp3d
- Cloreto de antimônio (V) (SbCl5)
- Fluoreto de antimônio (III) (SbF3)
- Cloreto de antimônio (III) (SbCl3)
- Brometo de antimônio (III) (SbBr3)
- Iodeto de Antimônio (III) (SbI3)
compostos oxigenados
- Óxido de antimônio (III) (trióxido de antimônio, Sb2O3)
- Óxido de antimônio (III, V) (tetróxido de antimônio, Sb2O4)
- Óxido de antimônio (V) (pentaóxido de antimônio, Sb2O5)
- Ácido de antimônio / trihidróxido de antimônio (H3SbO3 / Sb (OH) 3)
- Ácido antimônio / ácido antimônio (III), SbOOH ou HSbO2
- Ácido antimônico (HSb (OH) 6)
compostos de enxofre
- Trissulfeto de antimônio, também chamado de brilho de antimônio (Sb2S3)
Hastes metálicas cinza-pretas e brilhantes. Material de partida para a produção de antimônio metálico. Solúvel em ácidos fortes. Use para jogos, esfregando óculos e tintas de camuflagem (reflexo da luz IR). - Pentassulfeto de antimônio, anteriormente conhecido como enxofre de ouro (Sb2S5)
Outros compostos
- Fluoreto de cloreto de antimônio (V) (SbCl4F) (catalisador para a produção de politetrafluoretileno ("Teflon"))
- Antimoneto de Alumínio (AlSb)
- Antimoneto de Gálio (GaSb)
- Antimoneto de índio (InSb)
Gráfico de antimônio 2005-2020
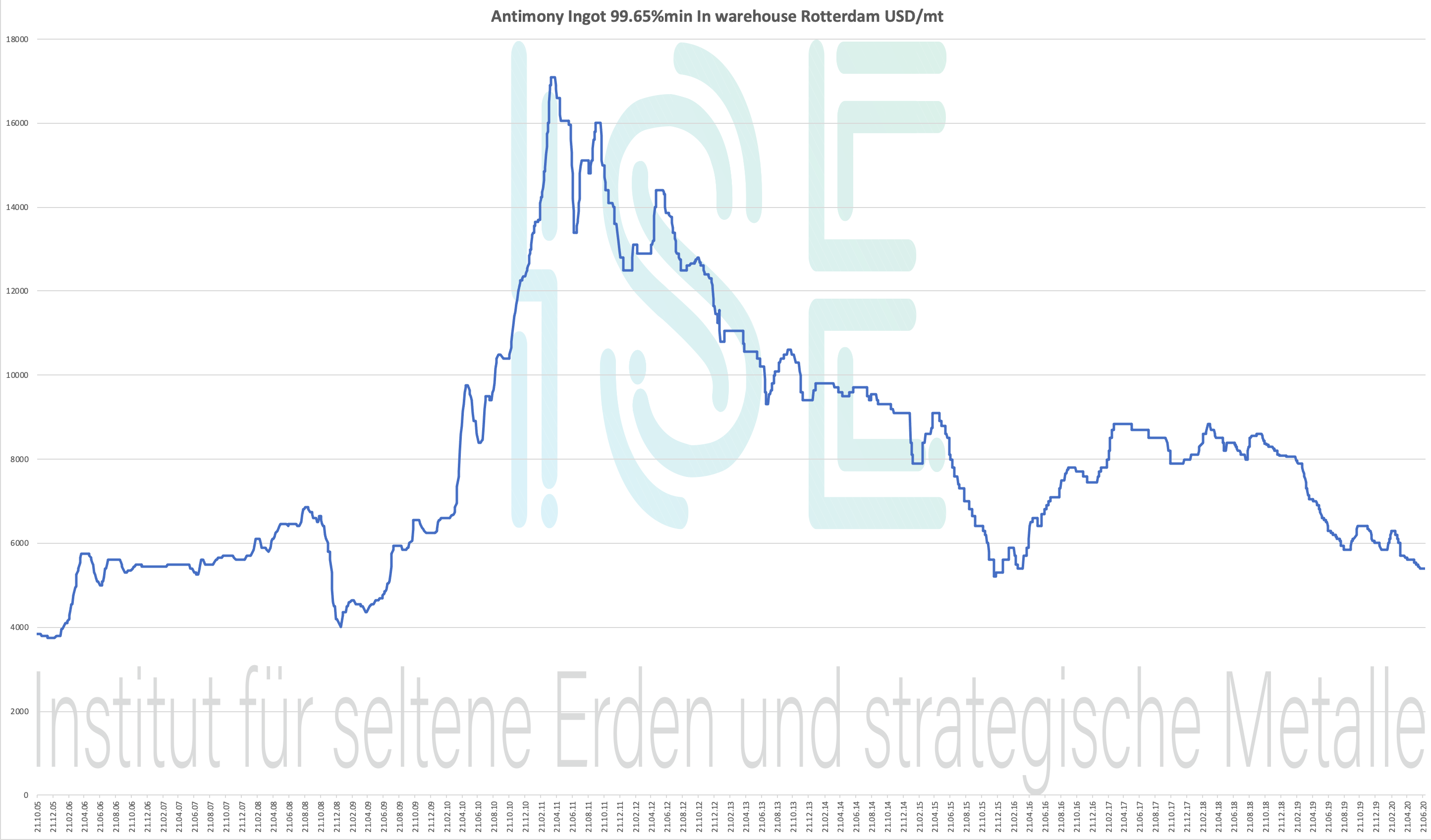
Lingote de antimônio 99.65% min Em armazém Rotterdam USD / mt
Tabela de preços 2004-2020 - clique para ampliar
Preço do antimônio - abaixo do preço estratégico dos metais
Dados históricos de preços de Armazém de lingote de antimônio 99,65% entre armazéns Roterdã USD / mt



