Cromo, Cr, número atômico 24
Cromo - Extração de cromo, uso, preços
geral
O cromo (alt. Chρῶμα chrṓma, color ') é um elemento químico com o símbolo Cr e o número atômico 24. Pertence aos metais de transição, na tabela periódica que está no 6. Subgrupo (grupo 6) ou grupo cromo. Os compostos de crómio têm muitas cores diferentes e são frequentemente utilizados como pigmentos em tintas e vernizes.
recuperação
O minério de cromita extraído é liberado da rocha morta. Na segunda etapa, uma digestão oxidante ocorre a aproximadamente 1200 ° C para dar o cromato:
O cromato de sódio é extraído com água quente e convertido em dicromato com ácido sulfúrico:
O dicromato de sódio cristaliza no arrefecimento como um di-hidrato da solução. Uma redução subsequente com carbono dá óxido de cromo (III):
Isso é seguido pela redução aluminotérmica do óxido de cromo (III) para cromo:
O cromo não pode ser obtido a partir de minérios oxidados por redução com carvão, pois isso resulta em carboneto de cromo. O cromo puro é produzido por eletrodeposição do Cr3+Íons da solução de ácido sulfúrico mostrada. Soluções correspondentes são preparadas dissolvendo óxido de cromo (III) ou ferrocromo em ácido sulfúrico. No entanto, o ferrocromo como material de partida requer uma separação prévia do ferro.
O cromo extremamente puro é produzido por outras etapas de purificação usando o processo van-Arkel-de-Boer.
O ferrocromo é produzido pela redução da cromita em um forno elétrico a arco a 2800 ° C.
Propriedades
O cromo é um metal duro branco prateado, resistente à corrosão e manchas, que é duro, maleável e moldável em seu estado original. É antiferromagnético com uma temperatura Néel de 475 K.[11] O cromo se dissolve em ácido clorídrico e ácido sulfúrico após algum tempo com a evolução do hidrogênio, quando a camada protetora de óxido desaparece. Os níveis de oxidação comuns do cromo são +2, +3 e +6, com +3 sendo o mais persistente.
Cr (II) é d4-Configuração instável. Quase não existe outro agente redutor que absorva o oxigênio do ar tão rapidamente quanto o Cr (II). Mas mesmo sem admissão de ar, Cr2+-Soluções são estáveis apenas por um curto período de tempo se forem obtidas a partir do cromo mais puro (por exemplo, eletrólito de cromo).
Cr3+ é a forma mais estável. Isso é explicado pela teoria do campo cristalino, segundo a qual o d3 A configuração é estabilizada por um shell inferior com metade do preenchimento.
Cr (VI) como cromato (CrO42-) ou dicromato (Cr2O72-) é usado como um agente oxidante forte. É tóxico e cancerígeno. Em soluções aquosas, existe um equilíbrio químico entre os dois íons que é dependente do pH. Se você acidificar uma solução diluída de cromato amarelo, você dá H.+-Além disso, de acordo com LeChatelier o equilíbrio muda na direção do dicromato, a solução fica laranja.

- Instruções de segurança e significado biológico
O papel do Cr (III) (Cr3+Íons) no corpo humano é atualmente objeto de controvérsia. Há indícios de que o Cr (III) pode ter um papel no metabolismo de carboidratos e gorduras de mamíferos. Esta informação está sendo acompanhada. Indicações anteriores de que o popular suplemento dietético Cr (III) -picolinato tem um efeito benéfico na estrutura corporal não puderam ser confirmadas em estudos posteriores. Um estudo com células de hamster mostrou que o picolinato de Cr (III) é mutagênico e pode causar câncer.
Os dados atualmente disponíveis indicam que é extremamente improvável que sofra de deficiência de cromo. Mesmo doses mais altas de Cr (III) desencadeiam um efeito tóxico apenas com dificuldade, pois o produto de solubilidade do hidróxido de Cr (III) é extremamente baixo (6,7 x 10-31) Portanto, é presumivelmente muito difícil de ser absorvido no intestino humano. Nos EUA, o nível de ingestão recomendado de Cr (III) foi reduzido de 50–200 µg / dia para 35 µg / dia em homens adultos e para 25 µg / dia em mulheres adultas.
Os compostos de Cr (VI) são extremamente tóxicos. Eles são mutagênicos e danificam o DNA. Eles entram no corpo pelas vias aéreas e danificam o tecido pulmonar. Pessoas cronicamente expostas a esses compostos têm um risco aumentado de desenvolver câncer de pulmão. O efeito venenoso aumenta com a insolubilidade do sal. A diretiva RoHS restringe severamente o uso de compostos Cr (VI) na Europa.
Usar
Os compostos de cromo e cromo são usados em uma ampla variedade de aplicações onde sua durabilidade é usada:
- cromagem dura: aplicação galvânica de uma camada de proteção contra desgaste de até 1 mm de espessura diretamente sobre aço, ferro fundido, cobre. O alumínio também pode ser cromado após a aplicação de uma camada intermediária (cilindros de alumínio cromado duro na construção do motor).
- Dekorverchromung: Aplicação galvânica de uma camada de Cr de <1 μm de espessura como decoração com uma camada intermediária protetora de corrosão de níquel ou níquel-cobre. As peças de plástico também são frequentemente cromadas. Um substituto para o cromagem decorativo é o processo acrólito.
- passivação camadas de zinco galvânico (chromating)
- liga elemento: em aços inoxidáveis resistentes à corrosão e ao calor e ligas não ferrosas
- Catalisador: para ativar ou acelerar reações químicas
- curtimento de cromo: o principal método de fabricação de couro
Conexões
- Chrome Oxide
- Óxido de cromo (III) Cr2O3, é usado como tinta esmalte e para colorir vidros (garrafas verdes) (também verde ponte de Colônia). Isso não deve ser confundido com o verde cromo tóxico.
- cromo amarelo
- Cromato de chumbo (II) PbCrO4, usado para servir como um pigmento de cor amarela brilhante ("Pós-amarelo"). Devido à sua toxicidade, agora é quase completamente substituído por pigmentos de cor orgânicos. Em análise, é usado para a determinação iodométrica de chumbo.
O amarelo cromo, que é usado como tinta artística, é um sulfato de chumbo / cromato de chumbo (cerca de 2 PbSO4 · PbCrO4) O pigmento foi descoberto por Louis-Nicolas Vauquelin em 1809 e é produzido comercialmente na Alemanha desde 1820. O amarelo cromo tem um alto poder de cobertura, sua estabilidade à luz depende do tom amarelo. O amarelo cromado raramente é usado em pinturas a óleo. Vincent van Gogh, entretanto, usou amarelo cromado a. uma. nas famosas pinturas de girassóis executadas a óleo sobre tela. Hoje, porém, alguns deles sofrem de descoloração dos tons amarelos.
O tecnólogo de arte Prof. Christoph Krekel da Academia de Arte de Stuttgart sobre o uso do pigmento cromo amarelo: "Os pintores caíram no amarelo cromado, porque é um amarelo muito brilhante - tem uma grande intensidade de cor, ou seja, você pode criar uma pintura muito mais brilhante com a ajuda deste novo tom amarelo".
O cromo amarelo também é uma cor importante na análise de falsificação de pinturas "antigas".
- dióxido de crómio
- Óxido de cromo (IV) CrO2, é um pó ferromagnético preto para a produção de fitas magnéticas com uma melhor relação sinal-ruído do que as fitas magnéticas de óxido de ferro convencionais porque o dióxido de cromo tem uma coercividade mais alta.
- ácido crómico
- com a estrutura hipotética H2CrO4 existe apenas em solução aquosa diluída. É muito venenoso. Existe como um ânion em alguns cromatos e dicromatos.
O anidrido do ácido crômico, o óxido de cromo (VI) muito venenoso CrO3, é conhecido como trióxido de cromo.
O laranja, muito venenoso dicromato de potássio K2Cr2O7 é um poderoso agente oxidante: Em uma solução de ácido sulfúrico, os álcoois primários são facilmente convertidos nos aldeídos relevantes, que podem ser usados para a detecção semiquantitativa de álcool na respiração. No laboratório, estava na forma de ácido crómico usado para limpeza de artigos de vidro. Em contato com íons de cloreto, no entanto, o volátil, cancerígeno cromilo CrO2Cl2 formado (dedução!). O dicromato de potássio também é usado como titulante e como fixador em banhos de corantes industriais. Dicromato de potássio e também muito venenoso dicromato de amónio (NH4)2Cr2O7 são a substância sensível à luz nas camadas de gelatina de cromo das primeiras fotografias (veja o processo de impressão fina).
- cromita
- (Tijolo de ferro cromado, veja acima) FeCr2O4 é usado para fazer moldes para tijolos queimados.
Preços, gráficos e dados históricos do Chromium
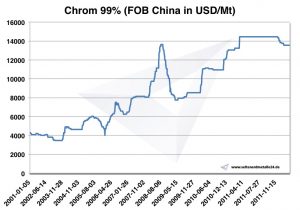
Gráfico Chrome 2001-2011








 = 3,1 10-4)
= 3,1 10-4)


