Índio, em, número atômico 49
Preço, ocorrência, extração e uso do índio
Geral
O índio é um elemento químico com o símbolo In e o número atômico 49. Na tabela periódica dos elementos está no 5º período e é o quarto elemento do 3º grupo principal (grupo 13 de acordo com a nova contagem) ou grupo do boro. O índio é um metal pesado raro, branco prateado e macio. Sua abundância na crosta terrestre é comparável à da prata. O índio não é essencial para o corpo humano, nem são conhecidos quaisquer efeitos tóxicos. A maior parte do metal agora é processada em óxido de índio e estanho, que é usado como condutor transparente para telas planas e telas sensíveis ao toque. Desde a virada do milênio, o aumento da demanda associada levou a um aumento significativo nos preços do índio e a discussões sobre a extensão dos depósitos.
O índio foi descoberto em 1863 pelos químicos alemães Ferdinand Reich e Theodor Richter em Bergakademie Freiberg. Eles examinaram uma amostra de esfalerita encontrada na área em busca de tálio. Em vez das linhas de tálio esperadas, eles encontraram uma linha espectral azul índigo anteriormente desconhecida no espectro de absorção e, portanto, um elemento até então desconhecido. O novo elemento foi mais tarde nomeado após isso. Pouco tempo depois, eles foram inicialmente capazes de produzir cloreto e óxido de índio, e o metal reduzindo o óxido de índio com hidrogênio. Uma grande quantidade de índio foi exibida pela primeira vez na Exposição Mundial de Paris em 1867.
Após seu primeiro uso em 1933 como um componente de liga no ouro dental, o uso extensivo do índio começou com a Segunda Guerra Mundial. Os Estados Unidos o usaram como revestimento em rolamentos de aeronaves altamente tensionados. Após a Segunda Guerra Mundial, o índio foi usado principalmente na indústria eletrônica, como material de solda e em ligas de baixo ponto de fusão. O uso em hastes de controle de reatores nucleares também se tornou importante com o uso crescente da energia nuclear. Isso levou ao primeiro aumento acentuado no preço do índio em 1980. No entanto, após o acidente do reator de Three Mile Island, a demanda e o preço caíram significativamente.
A partir de 1987, dois novos compostos de índio, o semicondutor fosfeto de índio e o óxido de índio e estanho transparente, que é condutor e transparente em camadas finas, foram desenvolvidos. O óxido de índio e estanho, em particular, tornou-se tecnicamente interessante com o desenvolvimento de telas de cristal líquido. Devido à alta demanda, a maior parte do índio foi processada em óxido de estanho e índio desde 1992.
ocorrência
O índio é um elemento raro, sua participação na crosta continental é de apenas 0,05 ppm. Tem, portanto, uma frequência semelhante à da prata e do mercúrio. Em seu estado sólido, o índio só foi encontrado em uma única descoberta no leste da Sibéria. Apenas alguns minerais de índio são conhecidos. Estes são principalmente minerais sulfídicos, como Indit FeIn2S4 e Roquésit CuInS2. No entanto, eles são raros e não desempenham um papel na extração de índio. Os maiores depósitos de índio estão em minérios de zinco, especialmente esfalerita. As reservas teóricas são estimadas em 16.000 toneladas, das quais cerca de 11.000 toneladas são economicamente recuperáveis. Os maiores depósitos estão no Canadá, China e Peru. Minérios contendo índio também são encontrados na Austrália, Bolívia, Brasil, Japão, Rússia, África do Sul, EUA, Afeganistão e alguns países europeus. Na Alemanha, existem depósitos nas montanhas de minério (Freiberg, Marienberg, Geyer) e no Rammelsberg nas montanhas de Harz.
Extração e apresentação
O índio é obtido quase exclusivamente como subproduto da produção de zinco ou chumbo. A extração econômica é possível se o índio se acumular em certos pontos do processo de produção. Isso inclui poeira de combustão que é gerada durante a torrefação do sulfeto de zinco e resíduos que são deixados para trás durante a eletrólise durante o processo úmido de produção de zinco. Estes são reagidos com ácido sulfúrico ou ácido clorídrico e, assim, colocados em solução. Como a concentração de índio no ácido é muito baixa, ele deve ser enriquecido. Isso é feito, por exemplo, por extração com fosfato de tributila ou precipitação como fosfato de índio.
A produção real de índio ocorre eletroliticamente. Uma solução de cloreto de índio (III) em ácido clorídrico é usada para isso. Este é convertido em índio elementar com a ajuda de eletrodos de mercúrio. Durante a eletrólise, deve-se tomar cuidado para que a solução não contenha mais tálio, pois os potenciais padrão dos dois elementos são muito semelhantes.

Usando processos adequados, tais como processos de fusão por zona ou eletrólise repetida de fusão de sal de cloreto de índio (I), o produto bruto pode ser purificado adicionalmente e, assim, pode ser obtido mais de 99,99% de índio puro.
Produção
A produção primária (produção mineira) de índio foi entre 2006 no ano 500 e 580 toneladas. Devido às baixas reservas naturais de 11.000 toneladas e alta demanda, o índio é uma das matérias-primas mais escassas do planeta. Em 2008, as informações sobre as reservas naturais de índio para a China em particular cresceram de 280 para 8.000 toneladas, o que aumentou o intervalo estático de 6 para 19 anos. A produção secundária, ou seja, reciclagem, excede a produção primária e foi de 2008 toneladas em 800.
A produção de índio na China só aumentou recentemente. Em 1994 a quantidade produzida ainda era de 10 toneladas. Desde então, a participação da China na produção mundial aumentou para 60% em 2005. A produção em outros países como Japão, Canadá ou França só pôde ser aumentada em pequena escala ou diminuída devido ao esgotamento dos depósitos. Em 2006, por exemplo, a mina japonesa Toyoha foi fechada, reduzindo significativamente a produção ali.
Como a demanda por índio aumentou mais rápido do que a produção, o preço do índio aumentou drasticamente de US $ 97 em 2002 para US $ 827 por quilo em 2005. O índio é reciclado principalmente pela reciclagem de resíduos da pulverização catódica. O único país onde o índio é recuperado em grandes quantidades é o Japão.
Se a demanda continuar a subir e o preço subir, a reciclagem de materiais com apenas uma pequena quantidade de índio se tornará lucrativa. Da mesma forma, faz sentido econômico explorar minérios com menores índices de índio. Isso provavelmente tornará possível retardar o esgotamento dos recursos.
O índio pode ser substituído por outras substâncias na maioria das aplicações, mas isso geralmente piora as propriedades do produto ou a lucratividade da produção. Por exemplo, o fosforeto de índio pode ser substituído por arsenieto de gálio, e alguns substitutos para o óxido de índio e estanho, embora de qualidade inferior, são possíveis.
Propriedades
Propriedades físicas
| sistema de cristal | tetragonal |
| grupo espacial |  |
| parâmetros de rede
(Unidade celular) |
a = (b) = 325 pm
c = 495 pm |
| Número (Z) de
unidades de fórmulas |
Z = 2 |

Célula unitária de índio com ambiente de coordenação do átomo central de índio

Poliedro de coordenação de um átomo de índio composto de 4 + 8 = 12 átomos vizinhos na forma de um cuboctaedro distorcido
O índio é um metal branco prateado com baixo ponto de fusão de 156,5985 ° C. Entre os metais, apenas o mercúrio, o gálio e a maioria dos metais alcalinos têm um ponto de fusão mais baixo. O metal é líquido em uma faixa muito grande de quase 2000 K. O índio líquido deixa permanentemente uma película fina no vidro (umedecimento). O gálio semelhante tem a mesma propriedade.
O metal possui alta ductilidade e baixíssima dureza (dureza de Mohs: 1,2). Portanto, é possível cortar o índio como o sódio com uma faca. Ao mesmo tempo, ele deixa uma linha visível no papel. O índio é supercondutor abaixo de uma temperatura de transição de 3,41 Kelvin. Uma peculiaridade do índio, que tem em comum com o estanho, são os ruídos característicos que podem ser ouvidos quando o índio é dobrado (“gritos de peltre”).
Apenas uma modificação cristalina é conhecida do índio em condições normais, que no sistema de cristal tetragonal no grupo espacial  e, portanto, em uma grade tetragonal centrada no corpo com os parâmetros da grade a = 325 pm e c = 495 pm e duas unidades de fórmula cristalizam na célula unitária.
e, portanto, em uma grade tetragonal centrada no corpo com os parâmetros da grade a = 325 pm e c = 495 pm e duas unidades de fórmula cristalizam na célula unitária.
Um átomo de índio é rodeado por doze outros átomos na estrutura cristalina, quatro dos quais vêm das células unitárias vizinhas e estão mais próximos (325 pm; ligações vermelhas) do que os oito átomos localizados nos cantos da célula unitária (337 pm; ligações verdes). O número de coordenação 4 + 8 = 12 resulta em um cuboctaedro distorcido como o poliedro de coordenação. A estrutura cristalina pode, portanto, ser descrita como um empacotamento de esferas cúbico tetragonalmente distorcido.
Em experimentos de alta pressão, outra modificação foi descoberta que é estável acima de 45 GPa e no sistema de cristal ortorrômbico no grupo espacial Fmmm cristalizado.
Propriedades químicas
As propriedades químicas do índio são semelhantes às de seu grupo vizinho ao gálio e ao tálio. Como os outros dois elementos, o índio é um elemento básico que pode reagir com muitos não-metais em altas temperaturas. No ar, é estável à temperatura ambiente porque, como com o alumínio, forma-se uma densa camada de óxido que protege o material de oxidação posterior por passivação. A reação ao óxido de índio (III) ocorre apenas em altas temperaturas.
Enquanto o índio é atacado por ácidos minerais como ácido nítrico ou ácido sulfúrico, não é solúvel em água quente, álcalis e na maioria dos ácidos orgânicos. Até mesmo a água salgada não ataca o índio. O índio é o metal mais solúvel em mercúrio à temperatura ambiente.
isótopo
Existem 38 isótopos diferentes e outros 45 isômeros de índio 97Em para 135Em conhecido. Apenas dois isótopos ocorrem na natureza, 113In (64 nêutrons) com 4,29% e 115Em (66 nêutrons) com 95,71% de participação na distribuição isotópica natural. O isótopo comum 115In é fracamente radioativo, é um emissor beta com meia-vida de 4,41 · 1014 Anos. Ambos os isótopos naturais podem ser detectados com a ajuda da espectroscopia de NMR. Os isótopos artificiais mais estáveis 111Em e 114mEm meias vidas de vários dias, 113mEm apenas cerca de uma hora e meia. 111Em e 113mSão usados na medicina nuclear.
Usar
Metal

Fio de índio é usado em vedações de índio.
O índio é versátil, mas seu uso é limitado por sua raridade e alto preço. A maior parte do índio produzido não é usado como metal, mas é processado em uma série de compostos. Para a produção de óxido de índio e estanho sozinho, 2000% da produção total de índio foi usada em 65. Outros compostos, como fosfeto de índio e arseneto de índio, também são obtidos a partir do índio produzido. Mais detalhes sobre o uso de compostos de índio podem ser encontrados na seção Conexões.
As peças de trabalho metálicas podem ser protegidas por revestimentos de índio depositados galvanicamente. Os materiais de aço, chumbo ou cádmio, por exemplo, revestidos desta forma são mais resistentes à corrosão por ácidos orgânicos ou soluções salinas e, sobretudo, à abrasão. No passado, as camadas protetoras de índio eram frequentemente usadas para rolamentos deslizantes em automóveis ou aeronaves. No entanto, desde o forte aumento no preço do índio, isso não é mais econômico. As superfícies revestidas com índio têm uma refletância alta e uniforme em todas as cores e, portanto, podem ser usadas como espelho.
O ponto de fusão do índio é relativamente baixo e pode ser determinado com muita precisão. Por isso, é um dos pontos fixos na hora de configurar a escala de temperatura. Esta propriedade também é usada para calibração em Calorimetria Diferencial Dinâmica (DSC).
Por causa da grande seção transversal de captura para nêutrons lentos e rápidos, o índio é um material adequado para hastes de controle em reatores nucleares. Folhas de índio também podem ser usadas como detectores de nêutrons. O índio é estanque ao gás e fácil de deformar mesmo em baixas temperaturas e, portanto, é usado nos chamados selos de índio em criostatos.
O índio também desempenha um papel como solda para muitos materiais devido a algumas propriedades especiais. Ele apenas se deforma ligeiramente quando esfria. Isso é especialmente importante ao soldar semicondutores para transistores. O fato de que o índio também é capaz de soldar materiais não metálicos, como vidro e cerâmica, também desempenha um papel.
Com as “pílulas de índio”, as plaquetas de germânio foram ligadas em ambos os lados para produzir os primeiros transistores.
ligas
O índio pode ser ligado a muitos metais. Muitas dessas ligas, principalmente com os metais bismuto, estanho, cádmio e chumbo, apresentam baixo ponto de fusão de 50 a 100 ° C. Isso resulta em possíveis aplicações em sistemas de sprinklers, termostatos e fusíveis, por exemplo. Como o chumbo, que também pode ser usado, é venenoso, o índio serve como um substituto inofensivo. O objetivo dessas ligas é que elas derretam quando a temperatura ambiente é muito alta, causada por fogo ou altas correntes. O derretimento então interrompe o circuito ou aciona o sistema de sprinklers. As ligas de índio-gálio freqüentemente têm pontos de fusão ainda mais baixos e estão contidas em termômetros de alta temperatura. Uma liga especial de gálio-índio-estanho é Galinstan. Este é líquido em temperatura ambiente e serve como um substituto inofensivo para o mercúrio ou ligas de sódio-potássio.
Existem várias outras ligas contendo índio que são usadas em diferentes áreas. O índio é usado com cobre, manganês e magnésio como um componente de liga em materiais magnéticos. Ocasionalmente, o índio (máximo 5%) com prata, estanho, cobre, mercúrio e zinco é usado como uma mistura em restaurações de amálgama. A camada de armazenamento de um CD-RW contém índio, entre outras coisas.
prova
Uma possível prova química é a precipitação dos íons índio com o auxílio da 8-hidroxiquinolina a partir da solução de ácido acético. Normalmente, o índio não é detectado por meios químicos, mas por métodos espectroscópicos adequados. O índio pode ser facilmente detectado usando as linhas espectrais características em 451,14 nm e 410,18 nm. Como estão na faixa espectral azul, resulta a cor típica da chama azul. A análise de fluorescência de raios X e a espectrometria de massa estão disponíveis como métodos de exame para uma determinação quantitativa mais precisa.
Toxicidade e segurança
Embora o índio metálico não tenha nenhum efeito tóxico, foi demonstrado que os íons índio têm efeitos embrionários e teratogênicos em experimentos com animais com ratos e coelhos. Com uma dose única de 0,4 mg * kg-1 InCl3 Malformações como fenda palatina e oligodactilia foram observadas em ratas grávidas. Esses fenômenos foram encontrados com maior frequência quando o índio foi aplicado no 10º dia de gravidez. Em contraste, não foram observadas malformações em camundongos. Foi constatado que o nitrato de índio é tóxico para os organismos aquáticos (toxicidade aquática).
O metal índio compacto não é inflamável. No estado finamente dividido como pó ou poeira, por outro lado, como muitos metais, é altamente inflamável e combustível. A queima do índio não deve ser extinta com água devido ao risco de explosão do hidrogênio produzido, mas deve ser extinta com extintores de metal (classe D).
Conexões
O índio forma vários compostos. Neles, o metal costuma ter o estado de oxidação + III. O nível + I é mais raro e mais instável. O estado de oxidação + II não existe; os compostos nos quais ocorre formalmente o índio divalente são, na realidade, compostos mistos de índio monovalente e trivalente.
índio
O óxido de índio (III) é um sal amarelo estável. O óxido de índio (III) puro raramente é usado; em tecnologia, a maior parte é processada em óxido de índio e estanho. É óxido de índio (III) dopado com uma pequena quantidade de óxido de estanho (IV). Isso transforma a conexão em um óxido transparente e condutor (material TCO). Esta combinação de propriedades, que apenas alguns outros materiais possuem, significa que é amplamente utilizado. O óxido de índio e estanho é usado principalmente como condutor em telas de cristal líquido (LCD), diodos emissores de luz orgânicos (OLED), telas sensíveis ao toque e células solares. Em outras aplicações, como vidros aquecidos de carros e células solares, o caro óxido de índio e estanho poderia ser substituído por óxido de zinco dopado com alumínio, mais barato.
composto semicondutor
Muitos compostos de índio são semicondutores compostos com lacunas de banda características. Isso se aplica em particular a compostos com elementos do 15º e 16º grupos principais, como fósforo, arsênio ou enxofre. Aqueles com elementos do 15º grupo principal são contados entre os semicondutores compostos III-V, aqueles com calcogênios entre os semicondutores compostos III-VI. O número depende do número de elétrons de valência nos dois componentes de conexão. Nitreto de índio, fosfeto de índio, arseneto de índio e antimoneto de índio têm diferentes aplicações em diferentes diodos, como diodos emissores de luz (LED), fotodiodos ou diodos laser. A aplicação exata depende do gap necessário. Sulfeto de índio (III) (In2S3) é um semicondutor III-VI com um gap de 2 eV, que é usado no lugar das células solares de sulfidina de cádmio. Alguns desses compostos - principalmente o fosfeto de índio e o arsenieto de índio - desempenham um papel na nanotecnologia. Os nanofios de fosfeto de índio têm uma fotoluminescência fortemente anisotrópica e podem ser usados em fotodetectores ou interruptores ópticos altamente sensíveis.
Além dos semicondutores compostos simples, também existem compostos semicondutores que contêm mais de um metal. Um exemplo é o arsenieto de índio-gálio (EmxGa1-xAs) um semicondutor ternário com um gap reduzido em comparação ao arseneto de gálio. Disseleneto de cobre e índio (CuInSe2) tem um alto grau de absorção de luz e, portanto, é usado em células solares de película fina (células solares CIGS).
Mais compostos de índio
O índio forma uma série de compostos com os halogênios flúor, cloro, bromo e iodo. Eles são ácidos de Lewis e formam complexos com doadores adequados. Um importante haleto de índio é o cloreto de índio (III). É usado, entre outras coisas, como um catalisador para a redução de compostos orgânicos.
Existem também compostos de índio orgânico com as fórmulas gerais InR3 e InR. Como muitos compostos organometálicos, eles são sensíveis ao oxigênio e à água. Compostos orgânicos de índio são usados como reagentes de dopagem na produção de semicondutores.
| Geral | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome, símbolo, número atômico | Índio, em, 49 | |||||||||||||||||||||||||||||||||
| série | metais | |||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 13, 5, p | |||||||||||||||||||||||||||||||||
| Aparência | cinza brilhante prateado | |||||||||||||||||||||||||||||||||
| número CAS | 7440-74-6 | |||||||||||||||||||||||||||||||||
| Fração de massa da concha de terra | 0,1 ppm | |||||||||||||||||||||||||||||||||
| nuclear | ||||||||||||||||||||||||||||||||||
| massa atômica | 114,818 u | |||||||||||||||||||||||||||||||||
| Raio atômico (calculado) | 155 (156) pm | |||||||||||||||||||||||||||||||||
| Raio covalente | 144 pm | |||||||||||||||||||||||||||||||||
| Van der Waals raio | 193 pm | |||||||||||||||||||||||||||||||||
| configuração electrónica | [Kr] 4d105s25p1 | |||||||||||||||||||||||||||||||||
| 1. ionização | 558,3 kJ / mol | |||||||||||||||||||||||||||||||||
| 2. ionização | 1820,7 kJ / mol | |||||||||||||||||||||||||||||||||
| 3. ionização | 2704 kJ / mol | |||||||||||||||||||||||||||||||||
| fisicamente | ||||||||||||||||||||||||||||||||||
| estado físico | fest | |||||||||||||||||||||||||||||||||
| estrutura de cristal | tetragonal | |||||||||||||||||||||||||||||||||
| densidade | 7,31 g / cm3 | |||||||||||||||||||||||||||||||||
| dureza de Mohs | 1,2 | |||||||||||||||||||||||||||||||||
| magnetismo | diamagnético ( = -5,1 10-5) = -5,1 10-5) |
|||||||||||||||||||||||||||||||||
| ponto de fusão | 429,7485[4] K (156,5985 ° C) | |||||||||||||||||||||||||||||||||
| ponto de ebulição | 2345 K (2072 ° C) | |||||||||||||||||||||||||||||||||
| Volume molar | 15,76 · 10-6 m3/ mol | |||||||||||||||||||||||||||||||||
| Calor de vaporização | 231,8 kJ / mol | |||||||||||||||||||||||||||||||||
| calor de fusão | 3,26 kJ / mol | |||||||||||||||||||||||||||||||||
| pressão de vapor | 1 Pa a 1196 K | |||||||||||||||||||||||||||||||||
| velocidade do som | 1215 m / s em 293,15 K | |||||||||||||||||||||||||||||||||
| Capacidade de calor específico | 233 J / (kg · K) | |||||||||||||||||||||||||||||||||
| Condutividade elétrica | 12,5 · 106 A / (v · m) | |||||||||||||||||||||||||||||||||
| condutividade térmica | 81,6 W / (m K) | |||||||||||||||||||||||||||||||||
| Químico | ||||||||||||||||||||||||||||||||||
| estados de oxidação | 3, 1 | |||||||||||||||||||||||||||||||||
| potencial normais | -0,343 V (In3+ + 3e- → In) | |||||||||||||||||||||||||||||||||
| eletronegatividade | 1,78 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| isótopo | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| propriedades de RMN | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| segurança | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
Preço do índio
Preços de índio -> Preços estratégicos de metais
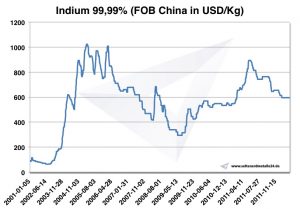
Gráfico Indium 2001-2011



