Cádmio, cd, número atômico 48
Preço, história, ocorrência, extração e uso de cádmio
Cádmio (cádmio com pouca frequência; grego καδμία kadmía, Cadmea ;, óxido de zinco latina ou terra 'contendo carbonato-) é um elemento químico com o elemento de símbolo Cd e número atómico 48. Geralmente é contado entre os metais de transição, embora tenha uma concha d fechada e, portanto, mais semelhante aos elementos do grupo principal, especialmente os metais alcalino-terrosos. Na tabela periódica está no 5. Período, bem como o 2. Subgrupo (grupo 12) ou grupo zinco.
História
A 1817 descobriu de forma independente o cádmio no carbonato de zinco contaminado por Friedrich Stromeyer e Carl Samuel Hermann. Stromeyer notou que o carbonato de zinco contaminado descoloriu durante o aquecimento - um comportamento que não mostrou carbonato de zinco puro. Por quase 100 anos, o metal só foi ganho na Alemanha.
Plínio, o Velho informou em sua escrita por volta do ano 77 Natural History Naturalis Historia de Galmeifunden em Germania: "Cadmea [...] ferunt Nuper etiam em Germania provincia repertum" (em alemão: "Recentemente, foi encontrado na província de Germania calamina"). O termo cádmio já era usado na Idade Média, provavelmente para zinco ou seu minério de carbonato. Como pode ser visto a partir de um pelo imperador Frederico II. Em abril 1226 em Ravenna emitiu o certificado, que concede ao mosteiro beneditino de St. Paul, no Vale Lavant o caminho certo "ut Cadmiae tam argentj quam plumbi et ferrítico, that no territorio ipsius monasteri de Cetero inveniri contigerint "ad opus suum" (em alemão: "que o zinco, bem como a prata, bem como o chumbo e o ferro, que se encontram na área do mosteiro, são utilizados para esse propósito").
Apesar da toxicidade de cádmio e os seus compostos da British Pharmaceutical Codex gravado 1907 de iodeto de cádmio como um agente para o tratamento de articulações inchadas (inchaço das articulações), glândulas escrofulosas (glândulas escrofulosas) e congelação (frieiras).
1907 a União Internacional Astronomical definido um angstroms quanto as vezes 1 / 6438,4696 o comprimento de onda de uma linha espectral vermelho de cádmio em ar seco, com um teor de dióxido de carbono de 0,03% a uma temperatura de 15 ° C e uma pressão de 1 atm. A Conferência Geral 1960 sobre Pesos e Medidas aceitou o comprimento de onda 1.553.164,13 de uma linha espectral vermelha de cádmio como a definição secundária de um metro.
A 1942 usou folhas de cádmio Enrico Fermi no primeiro reator nuclear do mundo. As folhas podem ser empurradas para dentro e para fora do reator para controlar a reação em cadeia. O cádmio pode capturar nêutrons de gap moderado e, assim, influenciar a criticidade do reator.
ocorrência
O cádmio é um elemento muito raro. Sua participação na crosta terrestre é de apenas cerca de 3-5 . O cádmio raramente ocorre na forma sólida, ou seja, na forma elementar. Até agora, apenas cinco locais em três países são conhecidos: o rio Khann'ya na bacia de Vilyui, a bacia do rio Jana perto de Verkhoyansk e a intrusão de Billeekh na República Russa de Sakha (Yakutia, Sibéria Oriental); os poços de Goldstrike perto de Lynn no condado de Eureka, Nevada, e o maciço Burabaiskii na área de Aqumola, no Cazaquistão.
Quando minérios contendo cádmio especialmente o obturador de cádmio (CdS Greenockit) com até 77,81% Cd e Cadmiumspat otavite (CdCO3) são conhecidos até 65,20% Cd, mas estas são muito pouco frequente para a mineração comercial. Ambos estão quase sempre associados a vários minérios de zinco, como a esfalerita (ZnS) e a smithsonita (ZnCO3).
No total até agora (stand 2018) algo mais do que os minerais de cádmio 20 são conhecidos. O muito raro Monteponite de óxido de cádmio tem o maior conteúdo de Cd até 87,54%. Outros minerais incluem Hawleyit (77,81% Cd), Cadmoselite (58,74% Cd) e Drobecit (IMA 2002-034, 40,07% Cd).
Cádmio como mineral
O cádmio de ocorrência natural na sua forma elementar foi descrito pela primeira vez por 1979 BV Oleinikov, AV Okrugin e NV Leskova. e reconhecido pela International Mineralogical Association (IMA) como uma espécie mineral independente (IMA Internal Accession Number: 1980-086a).
De acordo com a classificação de minerais de acordo com Strunz (edição 9) o cádmio está sob o sistema não. 1.AB.05 (Elementos - Metais e Intermetálicos - Família Zinco-Latão - Grupo Zinco). No 8 desatualizado. No entanto, o cádmio ainda não está listado na edição da Sistemática Mineral de Strunz. Apenas no último 2018 atualizado "diretório mineral Lapis", que é baseado nesta forma de sistema de numeração em consideração para colecionadores particulares e coleções institucionais, o mineral recebeu o sistema e mineral não. I / A.4-40. A classificação de minerais de acordo com Dana, que é predominantemente usada em países de língua inglesa, leva o elemento mineral sob o sistema não. 01.01.05.02.
Extração e apresentação
O cádmio é obtido exclusivamente como subproduto da fundição de zinco e, em menor escala, da fundição de chumbo e cobre. Pequenas quantidades também se aplicam à reciclagem de ferro e aço.
A produção de cádmio depende de como o zinco é extraído. Na extração seca de zinco, o cádmio é primeiro reduzido com o zinco. Como o cádmio tem um ponto de ebulição menor que o do zinco, ele evapora com mais facilidade. Como resultado, uma mistura de cádmio-zinco evapora do vaso de redução e reage em outro lugar com oxigênio ao cádmio e óxido de zinco. Subsequentemente, esta mistura é misturada num recipiente de destilação com coque e destilada do cádmio do zinco. A destilação fracionada permite alcançar níveis mais elevados de cádmio.
Durante a extração com zinco úmido, os íons de cádmio dissolvidos são reduzidos e precipitados com pó de zinco. O cádmio resultante é oxidado com oxigênio para óxido de cádmio e dissolvido em ácido sulfúrico. Da solução de sulfato de cádmio resultante é obtida por eletrólise com ânodos de alumínio e cátodos de chumbo particularmente eletrólito cádmio puro.
Propriedades físicas
O cádmio é um metal prateado brilhante com uma densidade de 8,65 g / cm3. É macio (Dureza de Mohs 2), plasticamente deformável e também pode ser cortado com uma faca para puxar fios e martelar em folhetos.
O cádmio solidifica exclusivamente no sistema cristalino hexagonal no grupo espacial P63 / mmc (grupo espacial número 194). Os parâmetros de rede do cádmio puro são a = 0,2979 nm (corresponde a 2,98 Å) e c = 0,5617 nm (corresponde a 5,62 Å) para unidades de fórmula 2 por célula unitária.
Semelhante ao estanho, os ruídos típicos ocorrem quando dobra-se cádmio de pureza média (chamado estanho-estanho). O cádmio polido perde seu brilho no ar depois de alguns dias, mesmo que seja mais resistente à corrosão do que o zinco. Em ar gaseificado, forma um revestimento branco acinzentado contendo dióxido de carbono. Altamente aquecido, queima com uma chama avermelhada a amarela para formar o dióxido de cádmio, óxido de cádmio, acastanhado.
O CdO foi testado por sua alta toxicidade durante a Segunda Guerra Mundial pelos Estados Unidos por sua adequação como agente de guerra química.
Propriedades químicas
Em compostos químicos é geralmente divalente. É quimicamente semelhante ao zinco, mas tende a formar compostos complexos com o número de coordenação 4. No ar, o cádmio forma um escurecimento da superfície devido à oxidação. Em meio alcalino, a superfície é insolúvel, pesada em ácido sulfúrico e ácido clorídrico, e facilmente solúvel em ácido nítrico.
Usar
Devido à alta toxicidade do cádmio, sua importância diminui. Desde dezembro 2011 é proibido em jóias, ligas para soldar e em PVC na União Européia. Cádmio é ou foi usado:
- como proteção contra corrosão para materiais ferrosos (revestimento com cádmio)
- como revestimento de superfície para materiais de alumínio em engenharia militar (por exemplo, lançadores de foguetes)
- para baterias de níquel-cádmio
- para pigmentos de sulfeto de cádmio e selênio de cádmio amarelo a vermelho intenso para tintas e plásticos (entretanto, baixa importância prática devido a possíveis riscos à saúde, especialmente ao queimar artigos correspondentes)
- como metal de liga em ligas de baixo ponto de fusão, por exemplo, materiais de rolamento ou metal de Wood
- antes do que o lubrificante nos freios a disco
- como um componente de materiais de solda (solda), também para ligas de brasagem
- para a produção de semicondutores
- Óxido de cádmio como fósforo em tubos de televisão a preto e branco e adição em fósforo azul e verde de tubos de cor
- Óxido de cádmio como mistura de prata em contatos de comutação
- como material de proteção contra nêutrons térmicos e para hastes de controle na tecnologia nuclear devido à seção transversal particularmente alta do isótopo 113 para captura de nêutrons
- como fonte de radiação gama de alta energia (em torno de 7 MeV) de nêutrons térmicos para a geração posterior de pósitrons por geração de pares
- Sulfeto de cádmio em medidores de exposição cuja sensibilidade espectral é semelhante à do olho humano
- Telureto de cádmio como sensor sensível a infravermelhos para câmaras (matrizes de plano focal)
- em células solares de película fina como telureto de cádmio ou sulfeto de cádmio para geração de energia
- Estearato de Cd como estabilizante em plásticos, por exemplo em PVC (insensível à luz, mas entretanto de baixa importância prática devido a possíveis riscos para a saúde)
- anteriormente nos elementos normais de Weston para determinar a unidade de medida de tensão, 1 volts
- Ligas de bismuto de cádmio para fusíveis
- Ligas de prata-cádmio como um desoxidante na produção de prata esterlina
- para joalharia: ligas de ouro-cádmio ouro-verde
- lâmpada de cádmio
- lasers de hélio-cádmio
- Íons de cádmio para bloquear canais de cálcio ativados por voltagem em eletrofisiologia
para colorir vidro em amarelo, laranja e vermelho adicionando sulfureto de cádmio, selenieto e telureto ou suas misturas.
Os calcogenetos de cádmio sulfato de cádmio (amarelo), seleneto de cádmio (vermelho) e telureto de cádmio (preto) são importantes semicondutores II-VI. São produzidos, por exemplo, nanoparticulados como pontos quânticos (pontos quânticos) e usados, inter alia, em bioquímica in vitro.
prova
Como amostra preliminar de cádmio, o chamado “Glühröhrchenprobe” pode servir. Para este propósito, alguma substância em estoque é aquecida em um Glühröhrchen de alto ponto de fusão e reduz a mistura de óxido de sulfeto resultante com oxalato de sódio para os metais. Como componente volátil, o cádmio evapora e se deposita como um espelho de metal na parte superior do tubo.
Através da adição subsequente de enxofre e recozimento renovado, formas de sulfeto de cádmio do espelho de metal e vapor de enxofre, que é vermelho no calor e amarelo à temperatura ambiente. Esta mudança de cor pode ser repetida algumas vezes.
A reação de detecção de cátions de cádmio é a precipitação com solução de sulfeto ou sulfeto de hidrogênio-água como sulfeto de cádmio amarelo. Outros íons de metais pesados interferem nessa detecção, de modo que antes da separação dos cátions é realizada.
Para a determinação quantitativa de traços de cádmio, recomenda-se a polarografia. Os íons de cádmio (II) entram em um nível em 1 M KCl em -0,64 V (vs. SCE). Na faixa de ultra-traços, a voltametria inversa pode ser usada em eletrodos de mercúrio. Muito sensível é também o tubo de grafite AAS de cádmio. Aqui, 0,003 μg / l ainda pode ser detectado. O elemento relativamente volátil não tolera uma alta temperatura de pirólise. Um modificador de matriz, como o nitrato de paládio e magnésio, pode ajudar.
segurança
O cádmio é muito tóxico e os seus compostos são classificados como nocivos (como o telureto de cádmio), tóxicos (por exemplo, sulfureto de cádmio) ou muito tóxicos (óxido de cádmio); Há também uma suspeita razoável de um efeito carcinogênico em humanos. A poeira contendo cádmio ingerida causa danos aos pulmões, fígado e rins.
Nas áreas de trabalho onde os compostos de cádmio aquecidos são utilizados (estações de solda e banhos de cádmio), assegure uma boa ventilação ou extração. De acordo com a Portaria sobre Interdição Química, o teor de cádmio nos plásticos não deve exceder 0,01 por cento em peso (100 mg / kg). Este limite aplica-se a toda a União Europeia.
Desde dezembro, a 2011 aplica uma proibição mais rigorosa do cádmio em plásticos, tintas, estabilizadores e certos processamentos de metal sob o Regulamento REACH, entrada 23 no Anexo XVII. Anteriormente, a brasagem de prata continha 10% a 25% de cádmio, joias infantis até 30%, PVC 0,2%. Com o 10. Em dezembro 2011, a proibição de soldas contendo cádmio na soldagem e a produção e comercialização de jóias banhadas com cádmio foi ampliada. Além disso, todos os produtos contendo PVC, com exceção da reciclagem de PVC, também foram incluídos. Com o Regulamento (UE) 2016 / 217 do 16. Em Fevereiro 2016, o cádmio em certas tintas e vernizes foi adicionado à entrada 23 no Anexo XVII do Regulamento REACH. Além disso, o teor de cádmio em certas tintas e vernizes que contêm zinco ou produtos que o contêm tem sido limitado. Há exceções, por exemplo, devido à alta densidade de energia das baterias Ni-Cd nos aparelhos elétricos sem fio.
toxicologia
O cádmio é um subproduto inevitável da extração de zinco, chumbo e cobre na indústria química. O cádmio também pode ser encontrado em fertilizantes e pesticidas.
Gravação e perigos
A Organização Mundial de Saúde tem rebaixado repetidamente sua declaração sobre a ingestão tolerável de cádmio nos últimos anos, mais recentemente 2013 para uma ingestão mensal tolerável (TMI) de 25 μg por quilograma de peso corporal. A Autoridade Europeia para a Segurança dos Alimentos emitiu à 2009 um nível significativamente inferior de 2,5 μg por quilograma de ingestão semanal tolerável (TWI).
O cádmio é absorvido pelos seres humanos principalmente através dos alimentos. Os alimentos ricos em cádmio incluem: fígado, cogumelos, marisco e outros crustáceos, cacau em pó e algas secas. Além disso, a semente de linhaça contém muito cádmio, e é por isso que não se recomenda tomar mais do que 20 g de semente de linhaça diariamente. Além disso, desde a introdução de fertilizantes artificiais, houve um acúmulo de cádmio em terras agrícolas e, portanto, em quase todos os alimentos. Os recursos dos fosfatos são limitados e a maioria dos recursos está contaminada com cádmio ou metais pesados radioativos. O teor de cádmio dos depósitos de fosfato é muito diferente. Muitos países industrializados já introduziram um limite no cádmio em fertilizantes. Na Áustria, a concentração de cádmio é limitada a 75 mg / kg P2O5. Além disso, a fumaça do tabaco transporta quantidades relativamente altas de cádmio para os pulmões, de onde se espalha com o sangue no corpo.
Especialmente as pessoas que trabalham em fábricas com alto teor de cádmio correm maior risco. Mas também há perigos de lixões e obras de metal. A inalação de cádmio pode danificar seriamente os pulmões e até levar à morte. Acidentes na indústria - como na província chinesa de Guangdong - e décadas de emissões - como no caso da doença de Itai Itai (em humanos) e da doença de Gressenicher (no gado em pastoreio) - tornam claros os perigos reais.
Dano em humanos
O cádmio pode acumular-se gradualmente no corpo devido a razões industriais ou ambientais e causar um envenenamento crônico que é difícil de reconhecer.
O cádmio é absorvido da dieta para aproximadamente 5% no intestino. Com deficiência de ferro e cálcio, a taxa de absorção aumenta, sugerindo que todos os três metais usam a mesma via de transporte. O cádmio primeiro estimula no fígado a síntese de metalotioneínas, com as quais forma um complexo e é transportado através da corrente sanguínea para os glomérulos renais, onde é filtrado e retomado a partir dos túbulos renais. Nas células tubulares, o complexo metalotioneína-cádmio é metabolizado e o Cd é liberado. Aqui, novamente, o cd ativa uma síntese aumentada de metalotiona, que liga ainda mais cádmio. A acumulação nos rins causa danos a este órgão, resultando em proteinúria. Devido a esta ligação às proteínas, o cádmio é excretado apenas extremamente lentamente, a meia-vida do corpo permanece até aos 30 anos. Portanto, o conteúdo de cádmio aumenta desde o nascimento e diminui novamente com a idade de 50-60 anos.
O cádmio também danifica os ossos, levando a uma mobilização do cálcio. Cd compete no intestino com o cálcio pelos sítios de ligação da proteína de ligação ao Ca na mucosa intestinal. Além disso, o Cd bloqueia a ressíntese de 1,25-di-hidroxicolecalciferol (calcitriol) em células do túbulo renal. O 1,25-Dihydroxycholecalciferol é necessário para ativar a síntese da proteína de ligação ao cálcio na célula da mucosa intestinal. Em resumo, o cádmio provoca uma reduzida reabsorção de cálcio no intestino e no rim, assim como o aumento da excreção com a urina, com a consequência de uma libertação de cálcio dos ossos e, consequentemente, a degradação dos mesmos.
No caso de intoxicação aguda por cádmio, a excreção biliar pode ser assistida pela administração de penicilamina ou dimercaprol. Um tratamento eficaz, além do envenenamento agudo por cádmio, não é conhecido.
sintomas
- Diarréia, dor de estômago e vômito violento
- danos nos rins
- fraturas ósseas
- Danos ao sistema nervoso central
- Danos ao sistema imunológico
- Distúrbios da reprodução e possivelmente até infertilidade
- Transtornos mentais
- Possíveis danos no DNA e carcinogênese
- Perda do sentido do olfato
Conexões
→ Categoria: composto de cádmio
Óxidos e hidróxidos
- Óxido de cádmio CdO
- Hidróxido de cádmio Cd (OH) 2
halogenetos
- Fluoreto de cádmio CdF2
- Cloreto de cádmio CdCl2
- Brometo de cádmio CdBr2
- Iodeto de Cádmio CdI2
chalcogenides
- Sulfeto de cádmio CdS
- Selenide de cádmio CdSe
- CdTe telureto de cádmio
Outros compostos
- Sulfato de Cádmio CdSO4
- Nitrato de cádmio Cd (NO3) 2
- Cianeto de cádmio Cd (CN) 2
- Cd de estearato de cádmio (C17H35COO) 2
Preço de cádmio -> Preços estratégicos de metais
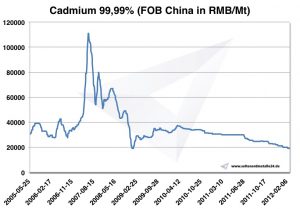
Cádmio de gráfico 2005-2012


