Magnésio, Mg, número atômico 12
Preço de magnésio, história, ocorrência, extração e uso
O magnésio é um elemento químico com o elemento símbolo Mg (Alquimia: ⚩) e o número atômico 12. Na tabela periódica dos elementos está no segundo grupo principal ou no 2. Grupo IUPAC e, portanto, pertence aos metais alcalino-terrosos.
O magnésio é um dos dez elementos mais comuns da crosta terrestre. Ocorre em numerosos minerais, bem como na folha verde das plantas.
História
A origem da designação do elemento é mostrada de maneira diferente na literatura:
- do grego antigo μαγνησία λίθος que significa "pedra magnética",
- Magnisia, uma área no leste da Grécia,
- de Magnésia, uma cidade na Ásia Menor no território da Turquia de hoje.
No entanto, todas as derivações dadas aqui parecem etimologicamente derivadas dos ímans ou do seu homônimo Heros Magnes.
Os compostos de magnésio eram conhecidos e usados durante séculos antes da produção de magnésio elementar. A magnésia alba designou carbonato de magnésio, enquanto a magnésia era o nome comum para o óxido de magnésio.
O físico escocês e químico Joseph Black foi o primeiro dos compostos de magnésio no 18. Século examinado sistematicamente. 1755 em seu trabalho De humore acido cibis orto et magnesia alba ele reconheceu a diferença entre o calcário (carbonato de cálcio) e a magnésia alba (carbonato de magnésio), que eram freqüentemente confundidos na época. Ele tomou Magnesia alba como o carbonato de um novo elemento. Por causa disso, o preto é freqüentemente chamado de descobridor do magnésio, embora ele nunca tenha representado o magnésio elementar.
1808 ganhou Sir Humphry Davy Magnésio hidreto de magnésio umedecido por eletrólise com o auxílio de uma coluna de cinza de Volta - não em forma pura, mas como amálgama, já que ele trabalhava com um cátodo de mercúrio. Então ele mostrou que Magnesia é o óxido de um metal novo, que ele chamou de Magnium.
Ao aquecer o cloreto de magnésio seco com potássio como agente redutor, a 1828 conseguiu produzir pequenas quantidades de magnésio puro para o químico francês Antoine Bussy. 1833 foi o primeiro a produzir magnésio por eletrólise do cloreto de magnésio fundido. Com base nesses experimentos, o químico alemão Robert Wilhelm Bunsen trabalhou nos anos 1840 e 1850 em processos para a produção de magnésio por eletrólise de sais fundidos usando o elemento Bunsen desenvolvido por ele. A 1852 desenvolveu uma célula de eletrólise para produzir maiores quantidades de magnésio a partir de cloreto de magnésio anidro fundido. Este processo ainda é preferido hoje para a recuperação do magnésio.
A produção técnica de magnésio começou a 1857 na França depois de um procedimento de Henri Etienne Sainte-Claire Deville e H. Caron. No chamado processo Deville-Caron, uma mistura de cloreto de magnésio anidro e fluoreto de cálcio é reduzida com sódio. Na Inglaterra, a Johnson Matthey começou a fabricar o 1860 usando um processo similar. No entanto, devido a dificuldades de fabricação, esses primeiros empreendimentos permaneceram antieconômicos.
ocorrência
O magnésio não existe na natureza por causa de sua reatividade na forma elementar. Como mineral, ocorre predominantemente na forma de carbonatos, silicatos, cloretos e sulfatos. Na forma de dolomita, um mineral de magnésio é mesmo formador de montanhas. B. nas Dolomitas.
Os minerais mais importantes são dolomita CaMg (CO3) 2, magnesita (Bitterspat) MgCO3, olivina (Mg, Fe) 2 [SiO4], enstatita MgSiO3 e Kieserit MgSO4 · H2O.
Outros minerais são:
- Serpentina Mg3 [Si2O5] (OH) 4
- Talco Mg3 [Si4O10] (OH) 2
- Sepolite Mg4 [Si6O15] (OH) 2
- Schönit K2Mg (NÚMERO DE SOX) 4 · 2 H6O
- Carnariano KMgCl3 · 6 H2O
- Spinel MgAl2O4
Quando dissolvido em água, causa a dureza da água junto com o cálcio. Na água do mar contém mais de 1 kg / m³.
Extração e apresentação
A extração do magnésio ocorre principalmente de duas maneiras:
- Por Electrólise por Fluxo de Derretimento de Cloreto de Magnésio Derretido em Células de Downs: As células de Down consistem em grandes calhas de ferro que são aquecidas por baixo. Como ânodos servem de cima de bastões de grafite embutidos, que são envolvidos nas pontas de um cátodo anular. O magnésio metálico acumula-se no sal fundido e é desnatado. O cloro gasoso resultante é coletado na parte superior da célula e é reutilizado para produzir cloreto de magnésio a partir do óxido de magnésio. Para baixar o ponto de fusão do cloreto de magnésio, adiciona-se cloreto de cálcio e cloreto de sódio ao sal fundido.
- Por redução térmica de óxido de magnésio (processo Pidgeon): Em um recipiente feito de aço cromo-níquel é dolomita queimada, barita e um agente redutor como ferrossilício, preenchido. É então evacuado (bombeado para fora do gás) e aquecido a 1160 ° C. O magnésio vaporoso condensa-se no tubo dianteiro resfriado a água fora do forno. O magnésio recuperado é ainda purificado por destilação a vácuo.
O processo Pidgeon é hoje o processo de fabricação mais significativo e é usado principalmente na China.
88% da produção mundial de magnésio ocorre na China, onde a 2015 produziu aproximadamente 800.000 t de magnésio metálico. Isto é seguido por apenas alguns por cento de participação de mercado na Rússia, Israel e Cazaquistão.
Na produção de 1 kg de magnésio por os Pidgeon Processo de gases com efeito de estufa, com um equivalente de cerca de CO2 31 kg (para comparação: Para 1 kg surgir aço entre 0,5 e 2 kg equivalentes CO2).
Embora o magnésio esteja contido em mais de 60 minerais, apenas dolomita, magnesita, brucita, carnalita, talco e olivina são de importância comercial.
O cátion Mg2 + é o segundo cátion mais abundante na água do mar, tornando a água do mar e o sal marinho atraentes fontes comerciais de magnésio. Para extraí-lo, o hidróxido de cálcio é adicionado à água do mar para formar um precipitado de hidróxido de magnésio.
O hidróxido de magnésio (brucite) é insolúvel em água e pode ser filtrado e reagido com ácido clorídrico para dar cloreto de magnésio concentrado.
A eletrólise produz cloreto de magnésio a partir de cloreto de magnésio.
Propriedades
A liga de magnésio, sólida e prateada, é cerca de um terço mais leve que o alumínio. O magnésio puro tem baixa resistência e dureza. Seu módulo é sobre 45 GPa. No ar, o magnésio é revestido com uma camada de óxido, que, ao contrário do alumínio, não é completamente opaco. A razão para isto é que o óxido de magnésio tem um volume molar mais baixo que o próprio magnésio (MgO: 10,96 cm3 / mol, Mg: 13,96 cm3 / mol); s. proporção Pilling-Bedworth.
Tiras finas ou folhas são facilmente inflamadas. Queima no ar com uma chama branca brilhante a óxido de magnésio MgO e pouco nitreto de magnésio Mg3N2. O pó de magnésio recém-feito pode aquecer no ar até que ele se manifeste espontaneamente. Reações perigosas são esperadas em temperaturas mais altas, especialmente com líquidos derretidos. Também em muitos óxidos, como o monóxido de carbono, o óxido de nitrogênio e o dióxido de enxofre, queimam magnésio.
O magnésio reage com a água para formar hidrogênio:
Reação de magnésio com água
Isto forma um revestimento fracamente solúvel de hidróxido de magnésio, o qual em grande parte interrompe a reação (passivação). Mesmo os ácidos fracos, como os sais de amônio, são suficientes para dissolver a camada de hidróxido, pois convertem os íons de hidróxido em água e formam sais solúveis. Sem passivação, a reação exotérmica prossegue violentamente; quanto mais fino o pó de magnésio, mais violento. Com o ar, o hidrogênio liberado forma facilmente uma mistura explosiva (gás oxi-hidrogênio).
O magnésio reage exotermicamente com dióxido de carbono para formar óxido de magnésio e carbono:
Reação de magnésio com dióxido de carbono
Portanto, o dióxido de carbono não extingue os incêndios de magnésio, mas os alimenta.
É relativamente resistente ao ácido fluorídrico e às bases, em contraste com o alumínio. A razão para isso é a baixa solubilidade do fluoreto de magnésio (MgF2), que impede a formação adicional de íons Mg (OH) 3.
isótopo
Há um total de isótopos 21 entre 19Mg e 40Mg de magnésio conhecidos. Destes, três, os isótopos 24Mg, 25Mg e 26Mg são estáveis e ocorrem na natureza. O isótopo com a maior proporção da composição isotópica natural é 24Mg com 78,99%, 25Mg tem uma parte de 10,0% e 26Mg de 11,01%. Os isótopos instáveis de vida mais longa são 28Mg que se funde com uma meia-vida de horas 20,915 sob o decaimento beta em 28Al e 27Mg, que decai com uma meia-vida de minutos 9,435 também sob o decaimento beta para 27Al. Todos os outros isótopos têm apenas meias-vidas curtas de segundos ou milissegundos.
Usar
Magnésio metálico
O pó e o fio de magnésio são usados em dispositivos incendiários, bombas e munição de luz, antigamente também como pó de flash. Freqüentemente, as hastes de magnésio atuam como ânodos de sacrifício, protegendo partes de metais mais nobres da corrosão.
Na metalurgia, o magnésio encontra uso versátil,
- como agente redutor no processo Kroll para a recuperação de titânio,
- como agente redutor para a recuperação de urânio, cobre, níquel, cromo e zircônio,
- como constituinte de ligas de alumínio dos grupos AlSiMg e AlMg,
- como grânulos de magnésio para a dessulfuração de ferro e aço,
- como agregado para ferro fundido nodular,
- como a base de um grupo de ligas leves padronizadas para a construção de aeronaves e veículos a motor (estes fundidos exigem uma camada de cobertura de cloreto de magnésio fundido para proteção contra a entrada de ar e oxidação, veja tratamento de fusão),
- como combustível para tochas que queimam debaixo d'água.
Em química orgânica, é usado para fazer compostos de Grignard.
Porque o magnésio se inflama muito facilmente, também é usado como um isqueiro muito robusto. Esses blocos de magnésio, comercializados como Fire Starter Kits, têm de um lado uma haste cuja abrasão se inflama espontaneamente no ar, como a pedra de um isqueiro. O procedimento é muito semelhante ao método da Idade da Pedra de queimar sílex e pavio, com o magnésio desempenhando o papel de pavio. Primeiro, lascas são raspadas do bloco de magnésio com uma faca e colocadas sobre ou sob o combustível real. Então, raspando a parte de trás do "pederneira" (por exemplo, com a parte de trás da faca), geram-se faíscas o mais próximo possível das espiras de magnésio, a fim de incendiá-las.
ligas de magnésio
A característica mais importante das ligas de magnésio, que as tornaram mais importantes que o alumínio e suas ligas, é a construção leve que elas permitem. Com uma densidade de cerca de 1,75 g / cm³, a diferença para a construção leve de alumínio com uma densidade de 2,75 g / cm³ é clara. Além disso, o intervalo de fusão entre 430 e 630 ° C, ou seja, menor economia de energia. No entanto, as propriedades mecânicas, tais como resistência à tração e dureza são significativamente menores do que com ligas de alumínio. A baixa densidade tornou o magnésio interessante para aplicações móveis desde o início. A primeira grande aplicação ocorreu antes da Primeira Guerra Mundial na construção dos andaimes para as rígidas aeronaves do Zeppelin. Nos automóveis, ligas de magnésio foram usadas para fabricar partes do corpo e aros para todos os tipos de aplicações móveis.1930 tem usado cada vez mais ligas de magnésio na construção de aeronaves por causa de sua economia de peso, vôos mais eficientes e cargas úteis mais altas. Tudo isso levou a uma rápida expansão da produção de magnésio na Alemanha (Elektron da fábrica de produtos químicos Griesheim) e depois da 1940 também nos EUA. "Elektron" tornou-se um nome de marca registrada para as primeiras ligas de magnésio imediatamente após o início da produção.
Outros usos para fundição de magnésio se ofereceram no decorrer do desenvolvimento técnico, em parte relacionados à guerra, parcialmente construtivos para o futuro e ao mesmo tempo otimizando as ligas. Como materiais à base de magnésio, as ligas Mg-Al, Mg-Mn, Mg-Si, Mg-Zn e, finalmente, ligas de Mg-Al-Zn foram desenvolvidas.
A caixa de engrenagens do Fusca foi moldada em milhões de camadas de uma liga de Mg-Si. Hoje, as ligas de magnésio não são usadas apenas do ponto de vista da economia de peso, mas também são caracterizadas por alta atenuação. Isto leva a uma redução da vibração e emissão de ruído quando sujeito a vibração. Também por essa razão, as ligas de magnésio se tornaram materiais interessantes na construção de motores, como na indústria automotiva. Assim, não apenas partes do motor são feitas de liga de magnésio, mas também cada vez mais para a fundição de blocos de motor, o método híbrido / fundido híbrido aplicado, pela primeira vez na produção em massa no Alfa Romeo 156, mais tarde também na BMW (ver também BMW N52).
Na fundição (ver também em moldagem) pode haver muitos, mesmo em larga escala, componentes de paredes finas perto das dimensões finais e produzir sem retrabalho caro, tal. Como jantes, perfis, caixas, portas, capôs, bootlid, alavanca do travão de mão e outros. Não só na indústria automotiva, mas também na engenharia mecânica é construída com partes de ligas de Mg-Al-Zn.
Os esforços para a construção leve já levaram ao fim do 20. Para ligas de magnésio-lítio, ligas ainda mais leves de magnésio com a adição de lítio.
Materiais de magnésio em medicina
Pesquisas recentes prometem um alto potencial de desenvolvimento de materiais de magnésio como material de implante reabsorvível (por exemplo, como um stent) para o corpo humano. Os materiais de magnésio devem ser protegidos contra corrosão por contato na aplicação. A resistência à corrosão contra influências atmosféricas normais, no entanto, é boa. O comportamento de corrosão do contato seria uma vantagem decisiva quando usado como material de implante temporário limitado, pois se dissolveria com segurança após um determinado período de tempo. Isso eliminou os riscos e custos de uma cirurgia de remoção de implantes.
fertilizante
Na calagem de áreas aráveis e pastagens, o magnésio na forma de óxido de magnésio ou carbonato de magnésio é usado para compensar a depleção de magnésio do solo pelas plantas novamente. Além disso, o pH do solo é aumentado e a disponibilidade de outros nutrientes é melhorada. Aqui, o composto de magnésio é geralmente aplicado em conjunto com cal como fertilizante complexo contendo magnésio e cálcio. Ocorre naturalmente como fosfato de magnésio de Bobierrit Mg3 (PO4) 2 (fosfato de trimagnésio) e nitrato de magnésio como fertilizante complexo.
fisiologia
O magnésio é uma das substâncias essenciais e, portanto, é indispensável para todos os organismos. Na folha verde das plantas, a clorofila, magnésio é contida em cerca de 2%. Ali forma o átomo central da clorofila. Na deficiência de magnésio, as plantas hibernam, assim como na falta de luz. Além disso, o corpo humano magnésio deve ser fornecido diariamente em quantidades suficientes para evitar a deficiência de magnésio.
O corpo de um adulto contém cerca de 20 g de magnésio (para comparação: 1000 g de cálcio). No plasma sanguíneo, o magnésio está ligado a 40% de proteínas; o nível sérico normal é 0,8-1,1 mmol / l. O magnésio está envolvido em algumas reações enzimáticas 300 como um constituinte enzimático ou coenzima. Além disso, íons Mg livres influenciam o potencial das membranas celulares e atuam como segundos mensageiros no sistema imunológico. Eles estabilizam o potencial de repouso das células nervosas e musculares excitáveis e das células do sistema nervoso autônomo. A deficiência de magnésio provoca inquietação, nervosismo, irritabilidade, falta de concentração, cansaço, sensação geral de fraqueza, dor de cabeça, arritmia cardíaca e espasmos musculares. Também pode chegar a um ataque cardíaco. Na área do metabolismo e da psique, acredita-se que a deficiência de magnésio exacerba a depressão e a psicose esquizofrênica. Um excesso de magnésio no sangue pode ocorrer como resultado da ingestão excessiva e disfunção renal e leva a distúrbios no sistema nervoso e no coração.
A reabsorção de magnésio ocorre primeiro no intestino delgado superior, mas também no resto do trato digestivo. É excretado pelos rins e está presente em quantidades variáveis em todos os alimentos, bem como na água potável. A dose diária necessária de cerca de 300 mg é geralmente alcançada através de uma dieta bem equilibrada. Um aumento da necessidade pode ser coberto por suplementos ou medicamentos. A deficiência leve de magnésio é possível devido a doença grave, gravidez ou esportes competitivos. As deficiências graves ocorrem na disfunção renal, diarréia prolongada, inflamação intestinal crônica, diabetes mellitus mal controlada, corticosteróides, certos diuréticos ou alcoolismo com desnutrição.
Os sais de magnésio tais como o citrato, gluconato, aspartato e aspartato são autorizados como medicamentos na Alemanha, no dia-a doses de 100 400 mg contra anomalias e doenças neuromusculares tais como espasmos musculares, enxaqueca ou complicações na gravidez. Os efeitos colaterais incluem desconforto gastrointestinal e diarréia, com overdose também fadiga e pulso abrandar. Contra-indicações incluem disfunção renal e certas arritmias cardíacas.
Para a ingestão oral de suplementos de magnésio (comprimidos, mastigáveis ou pastilhas, grânulos para dissolução em líquido), por um lado, a dosagem é importante. Vários estudos concluíram que, quando se toma 120 mg, aproximadamente 35% é absorvido, mas quando se toma uma dose diária completa de 360 mg, apenas cerca de 18% é absorvido. Para absorção no corpo, a forma dos compostos usados hoje em medicamentos é irrelevante, uma vez que eles são farmacologicamente e biológica e clinicamente equivalentes; Sais orgânicos, como aspartato de magnésio ou citrato de magnésio, são absorvidos apenas mais rapidamente pelo organismo do que os compostos inorgânicos. Por outro lado, o magnésio adicional permanece benéfico no corpo apenas se estiverem disponíveis moléculas de ligação suficientes no corpo; Isso é feito por ajustes bioquímicos somente após um aumento prolongado no suprimento ou ingestão de magnésio durante pelo menos quatro semanas. O sulfato de magnésio ("sal de Epsom") foi usado anteriormente como um laxante. Os sais de magnésio são usados na medicina alternativa.
Comida
O magnésio serve como co-fator para várias proteínas 300, especialmente ATP- e enzimas de ligação a ácidos nucléicos. A ingestão diária recomendada de magnésio em humanos, dependendo da idade e sexo, é entre 24 e 400 mg por dia.
O magnésio é uma ligação em muitos alimentos, especialmente grãos integrais (tais como pão de trigo integral, macarrão de trigo, arroz de grão inteiro, farinha de aveia, flocos de milho), água mineral, em particular de águas medicinais, água da torneira de dureza de água suficiente, fígado, aves de capoeira, peixe comestível, sementes de abóbora, sementes de girassol, de chocolate , Castanha de caju, amendoim, batata, espinafre, couve-rábano, frutos silvestres, laranjas, bananas, gergelim, xarope de beterraba, leite e produtos lácteos.
Perigos e medidas de proteção
Os perigos do magnésio elementar dependem muito da temperatura e do tamanho das partículas: o magnésio compacto é seguro em temperaturas abaixo do ponto de fusão, enquanto os pós de magnésio e os pós são altamente inflamáveis. Devido à grande superfície, este último pode reagir facilmente com o oxigênio no ar. Com pó de magnésio muito fino, existe o perigo de combustão espontânea; As misturas de pó de ar são até explosivas. A fleumatização é um tratamento de redução de riscos no processamento de magnésio, como pós metálicos em geral. O magnésio fundido também se inflama espontaneamente no ar. Mesmo com muitas outras substâncias, como água e outros compostos contendo oxigênio, reage magnésio de grão fino ou aquecido. O magnésio derrete, portanto, exige proteção permanente contra a entrada de oxigênio atmosférico. Na prática, isto é feito cobrindo o fundido por meio de agentes ricos em cloreto de magnésio. O hexafluoreto de enxofre também é adequado como proteção contra oxidação. A cobertura anteriormente usual com enxofre elementar não é mais praticada por causa do forte incômodo causado pelo dióxido de enxofre.
Em incêndios de magnésio, ocorrem temperaturas de até cerca de 3000 ° C. Em nenhuma circunstância podem ser utilizados agentes extintores comuns como água, dióxido de carbono, espuma ou nitrogênio, pois o magnésio reage violentamente com estes. Quando a água entra em um incêndio de magnésio, há um perigo agudo de uma reação oxyhydrogen.
Para o fogo (fogo de metal) de um fundido, aplica-se o princípio de sufocamento de extinção, ou seja, o deslocamento rápido de oxigênio. No caso mais simples, cobrindo com areia seca, caso contrário, aplicando um sal de cobertura para o magnésio derrete. Pó de extinção da classe de incêndio D, pó de magnésia (magnésia usta / magnésia queimada), se necessário, também pastilhas de mamona cinzentas secas a seco também são adequados.
Ao usar magnésio, portanto, todas as instruções de segurança devem ser seguidas exatamente. Sob nenhuma circunstância deve ser criada uma atmosfera explosiva (pó de magnésio, hidrogênio, aerossóis e vapores de lubrificantes combustíveis). As medidas normais de segurança ocupacional, como a prevenção de fontes de ignição, também devem ser observadas.
prova
A melhor maneira de detectar magnésio é com Magneson II, Titangelb ou Chinalizarin.
Para detecção com Magneson II (4- (4-nitrofenilazo) -1-naftol), a substância armazenada é dissolvida em água e tornada alcalina. Depois disso, algumas gotas de uma solução do azo corante Magneson II são adicionadas. Na presença de íons de magnésio, um lago azul escuro é formado. Outros metais alcalino-terrosos devem ser previamente removidos por precipitação como carbonatos.
Para detecção com Titangelb (Thiazolgelb G), a substância é dissolvida em água e acidificada. É então misturado com uma gota de solução de Titangelb e tornado alcalino com solução diluída de hidróxido de sódio. A presença de magnésio produz um precipitado vermelho vivo. Os íons níquel, zinco, manganês e cobalto interferem nessa detecção e devem ser precipitados primeiro como sulfetos.
Para detecção com quinalizarina, a solução de amostra ácida é misturada com duas gotas da solução de corante. Em seguida, a solução diluída de hidróxido de sódio é adicionada até a reação básica. Uma mancha azul ou precipitado indica magnésio.
Como uma reação de detecção para sais de magnésio e a formação de precipitados podem ser usados com soluções de sal de fosfato. O metal livre de metais pesados, com amônia e cloreto de amônio para pH 8 para solução de amostra tamponada 9 é adicionado a ele com solução de hidrogenofosfato dissódico. Uma turbidez branca solúvel em ácido devido ao fosfato de magnésio e amônio MgNH4PO4 indica íons de magnésio:
Da solução amoniacal Mg2 + também pode ser detectado com oxina como um composto amarelo-esverdeado fracamente solúvel. Esta prova é adequada para o processo de separação de cátions.
Conexões
Nos compostos, o magnésio ocorre quase exclusivamente como um cátion divalente com o estado de oxidação 2.
Óxidos e hidróxidos
Óxido de magnésio (magnésia) forma cristais incolores na estrutura de cloreto de sódio. Na natureza, ocorre como uma pericla mineral vulcânica. São brancos a cinzentos, inclusões também verdes escuras, cristais regulares vítreos brilhantes. É adicionado aos alimentos como um regulador de acidez ou agente de liberação e também tem várias aplicações de engenharia em laboratórios e na indústria. Na medicina, é usado para terapia de substituição.
O hidróxido de magnésio é um sal incolor e fortemente básico que ocorre naturalmente como um brucita mineral. Ele tem uma estrutura de cristal trigonal no P3m1 (grupo espacial não. 164) grupo espacial e é usado como aditivo de óleo de cozinha (para a ligação de dióxido de enxofre), como um floculante para o tratamento de águas residuais, como retardadores de chama em materiais termoplásticos (de poliolefinas, cloreto de polivinilo) e elastómeros, assim como um aditivo em detergentes usado. Na medicina, é usado como um antiácido para a neutralização do ácido gástrico e como um laxante suave usado.
O peróxido de magnésio é um composto incolor e finamente pulverizado que possui uma estrutura cristalina de pirita no grupo espacial Pa3 (grupo espacial número 205). Assemelha-se ao peróxido de cálcio e libera oxigênio por reação controlada com soluções aquosas. Tem várias aplicações em agricultura, farmácia e cosméticos.
halogenetos
O cloreto de magnésio é muito higroscópico e ocorre naturalmente na bischofite mineral (MgCl2 · 6 H2O), como um carnalite sal duplo (KMgCl3 · 6 H2O) em água do mar e em lagos de sal antes. Ele cristaliza no sistema de cristal trigonal no grupo espacial R3m (número do grupo espacial 166). Na tecnologia de alimentos, é usado como um regulador de acidez, consolidador, intensificador de sabor, transportador ou agente de liberação. O cloreto de magnésio hexa-hidratado, como uma bateria térmica, pode armazenar e liberar energia térmica.
O fluoreto de magnésio forma cristais incolores que cristalizam tetragonalmente na estrutura rutílica do grupo espacial P42 / mnm (grupo espacial número 136) grupo espacial. Suas propriedades ópticas e sua estabilidade química fazem dele um importante material para aplicações ópticas.
O brometo de magnésio e o iodeto de magnésio também são sais higroscópicos que possuem uma estrutura cristalina trigonal no grupo espacial P3m1 (número do grupo espacial 164).
Outros compostos inorgânicos
O carbonato de magnésio ocorre na natureza em grandes quantidades como magnesita (bitterspar). Cristaliza trigonal no grupo espacial R3c (número do grupo espacial 167). Na indústria alimentícia, é adicionado como um regulador de acidez, transportador ou agente de liberação. É usado para escalada e ginástica e também é conhecido como Magnesia e Chalk. Os atletas então se secam nas palmas das mãos antes de começarem a praticar, para que sua pele não fique muito aderida ao segurar as barras de barras ou as barras de ferro da barra horizontal ou barra. Também possui aplicações médicas e industriais.
O nitrato de magnésio é um sal higroscópico incolor que é facilmente solúvel em água. O hexa-hidratado (Mg (NO3) 2 · 6 H2O) tem uma estrutura de cristal monoclinica com grupo espacial P21 / c (grupo espacial não. 14). É usado como fertilizante, armazenamento de calor latente (como hexahidrato) ou na indústria de cerâmica.
O hepta-hidrato de sulfato de magnésio (Mg (SO4) 7 H2O) é conhecido como Epsomit Mineral. Forma cristais incolores que formam uma rede cristalina pseudotetragonal rômbica. Os cristais geralmente florescem em agregados fibrosos e formam estalactites. É usado para fertilizantes, como agente de secagem e para aplicação médica.
fosfato de magnésio (di-hidrogenofosfato de magnésio (Mg (H2PO4) 2), fosfato de hidrogénio de magnésio (MgHPO4) e fosfato de magnésio (Mg3 (PO4) 2)) são usadas na indústria como uma matéria prima de cerâmica e, como retardadores de chama. Na indústria alimentar, são utilizados como aditivo alimentar, laxante e aditivo alimentar. Alimentos são adicionados como um regulador de acidez ou agente de liberação.
Spinel é um mineral de ocorrência frequente da classe mineral de óxidos e hidróxidos com a composição química idealizada MgAl2O4 e é, portanto, quimicamente um aluminato de magnésio. Cristaliza isotipicamente com magnetita no sistema de cristal cúbico no grupo espacial Fd3m (número de grupo espacial 227).
A dolomita é um mineral muito comum da classe mineral de carbonatos e nitratos com a composição química CaMg [CO3] 2 e, portanto, é quimicamente um carbonato de cálcio e magnésio. Cristaliza no sistema de cristal trigonal no grupo espacial R3 (número do grupo espacial 148).
O hidreto de magnésio pode ser usado como hidrogênio e armazenamento de energia. O hidrogênio liberado do hidreto de magnésio pode produzir uma espuma de metal com propriedades interessantes que é mais leve que a água.
Outros compostos de magnésio cristalino interessantes incluem diboreto de magnésio, o carboneto de magnésio, o nitreto de magnésio, sulfureto de magnésio, o silicieto de magnésio, Magnesiumgermanid, metassilicato de magnésio, e Magnesiumtitanoxid Magnesiumpolonid.
organomagn�io
Órgãos de magnésio são compostos organometálicos nos quais existe uma ligação entre magnésio e carbono. Entre os compostos de Grignard de organomagnésio (R-Mg-X) são de longe os mais importantes. Órgãos de magnésio binário e haletos de alquenilmagnésio desempenham um papel significativamente subordinado.
Organylmagnesiumhalogenide
Os haletos de organilmagnésio (usualmente chamados de compostos de Grignard) são obtidos em um processo direto pela reação de haletos de organila com magnésio. Os compostos de Grignard estão em solução no equilíbrio de Schlenk. Eles reagem sob substituição de organogênios de halogênio em organelos elementares:
geral:
z. Por exemplo:
ou pela adição de organilos com múltiplos sistemas de ligação:
geral:
z. B.:
Órgãos de magnésio binário (R2Mg, também chamados de diorganils de magnésio) podem ser produzidos de várias maneiras:
por transmetalação, por exemplo, de diorganileno mercúrio:
por dismutação no deslocamento do equilíbrio de Schlenk com o auxílio de 1,4-dioxane:
Os magnesaciclos (alcanos cíclicos com um magnésio no anel) também podem ser preparados com 1,4 dioxano.
por metátese de compostos de Grignard com organelos de lítio
por hidromagnesização (adição de MgH2 a 1-alcenos):
pela adição de magnésio elementar a ligações duplas C = C em alguns hidrocarbonetos insaturados tais como 1,3-butadieno ou antraceno (adição de metal). Por exemplo, a reação de 1,3-butadieno em tetrahidrofurano à temperatura ambiente é possível:

O butadieno de magnésio produzido, também chamado de (2-buteno-1,4-diil) magnésio, pode servir como uma fonte de aniões de butadieno em sínteses posteriores. Da mesma forma, o antraceno de magnésio laranja-amarelo é mostrado. O antraceno de magnésio pode então ser usado como um catalisador para a hidrogenação do magnésio.
alkenylmagnesium
Os alcinos reagem com alcenos para dar halogenetos de alcenilmagnésio no decurso da designação de carbomagnesação:

Outros compostos orgânicos
O hidrogenocitrato de magnésio e o dicitrato de trimagnésio são sais de magnésio do ácido cítrico. O citrato de magnésio é usado como medicamento.
O monoperoxiftalato de magnésio é um desinfetante para a desinfecção da superfície.
O estearato de magnésio é o sal de magnésio do ácido esteárico e pertence aos sabonetes de cal. Consiste em um íon de magnésio e dois íons estearato de cadeia longa.
Preço de magnésio
Preços do magnésio -> preços para metais estratégicos
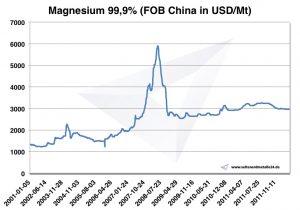
Gráfico Magnésio 2001-2011













