Silício, Si, número atômico 14
Preço, ocorrência, extração e uso do silício
O silício, também silício, é um elemento químico com o símbolo Si e o número atômico 14. Está no 4. Grupo principal (grupo de carbono) ou o 14. IUPAC Group e o 3. Período da Tabela Periódica dos Elementos. Em termos de fração de massa (ppmw), é o segundo elemento mais abundante na casca da terra após o oxigênio.
O silício é um semi-metal clássico, portanto tem propriedades de metais e não-metais e é um semicondutor elementar. O silício puro e elementar tem uma cor cinza-escura e tem um brilho tipicamente metálico, muitas vezes de bronze a azulado.
O silício é extremamente importante para a eletrônica e como o 2018 em forma isotópica pura serve também para a definição do quilograma. O silício elementar não é tóxico para o corpo humano, o silício na forma de silicato ligado é importante para os seres humanos. O corpo humano contém cerca de 20 mg / kg de massa corporal de silício; a quantidade diminui com a idade.
Ortografia e etimologia
Por padrão, o elemento 'silício' é gravado. A notação com, c 'é usada principalmente no jargão químico. Ambas as grafias são originárias do termo latino silicia, silica ', associado ao latim silex' pebble ',' rock '.
A palavra inglesa para silício é silício. Está incluído, por exemplo, no nome Silicon Valley. A tradução ocasionalmente encontrada de silicone é um falso amigo, porque os silicones são uma classe de compostos químicos de silício.
História
Uso em tempos pré-industriais
Compostos de silício, especialmente rochas, têm tradicionalmente desempenhado um papel importante na história humana como material de construção. Um exemplo típico de uma antiga estrutura de pedra é Stonehenge. Outro material silicoso importante que tem sido usado como material de construção por um longo tempo é o marga, que foi inicialmente usado na construção de argila de fibra ramificada, posteriormente em forma de tijolo. O cimento, que também contém silicato, foi primeiramente desenvolvido pelos romanos.
Devido às suas arestas vivas, as rochas silicosas também foram usadas como ferramentas na Idade da Pedra. A obsidiana, por exemplo, já foi extraída como material de ferramenta particularmente adequado no período proto-histórico e amplamente distribuída pelo comércio. Feuerstein foi extraído em áreas de giz, como a Bélgica e a Dinamarca. Na extração de metal, especialmente na fabricação de aço, a escória de silicato é usada para proteger os fogões e fornos de entrada de oxigênio e como argila ou moldes de areia; possivelmente a fabricação de vidro foi descoberta.
Descoberta como um elemento
Pela primeira vez no ano 1789 Antoine Lavoisier previu que Silex é o óxido de um metal. No ano 1807, Humphry Davy postulou testes eletroquímicos para a existência dos metais silício, alumínio, zircônio e glucônio (berílio).
"Se eu tivesse tido a sorte de obter este assunto, e de ter procurado as substâncias metálicas que estava procurando, eu deveria ter proposto os nomes de silício, alumium, zirconium e glucium."
"Se eu tivesse ficado tão feliz em ter evidências mais confiáveis sobre o assunto e ter ensinado as substâncias metálicas que eu procurava, teria sugerido para elas os nomes silício, alumínio, zircônio e glucium".
- Humphry Davy
Na 1811, o químico Joseph Louis Gay-Lussac e Louis Jacques Thénard (ver Thénards Blau) produziram silício amorfo e impuro (a-Si, a forma alotrópica não cristalina do silício). Para fazer isso, eles reagiram tetrafluoreto de silício com potássio elementar. Um procedimento similar foi seguido por Xnumx por Jöns Jakob Berzelius na Suécia, reagindo um hexafluorosilicato com potássio elementar. Berzelius limpou o silício amorfo resultante lavando-o. Ele foi o primeiro a reconhecer a natureza elementar do silício e deu-lhe o nome.
O termo silício é derivado da palavra latina silex (seixo, sílex). Ele expressa que o silício é mais comum em muitos minerais.
O termo inglês silício foi proposto à 1817 pelo químico escocês Thomas Thomson (1773-1852). A desinência -on destina-se a indicar a relação química com os não-metais carbono (carbono) e boro (boro).
A primeira produção de silício puro, cristalino no ano 1854 sucedeu ao químico francês Henri Etienne Sainte-Claire Deville por meio de eletrólise.
ocorrência
A terra inteira é cerca de 15 por cento em massa de silício; em particular, o manto é composto de uma extensão considerável de fundições de rocha de silicato. A crosta terrestre é cerca de 25,8 por cento em peso de silício; isso faz com que seja o segundo elemento químico mais abundante depois do oxigênio. Aqui, o silício ocorre essencialmente na forma de minerais de silicato ou como sílica pura.
Então areia consiste principalmente de sílica. O quartzo é sílica pura. Muitas gemas são feitas de dióxido de silício e mais ou menos misturas de outras substâncias, como ametista, rosa e quartzo de fumaça, ágata, jaspe e opala. O silício forma silicatos com muitos metais. Exemplos de rochas siliciosas são a mica, o amianto, a argila, o xisto, o feldspato e o arenito. Os oceanos também representam um enorme reservatório de silício: na forma de ácido silícico monomérico, é dissolvido em quantidades consideráveis em todos os oceanos. No total, há medida (como 2011) minerais silício 1437 conhecido em que o raro MOISSANITE com um teor de até 70%, o teor de silício mais elevado tem (em comparação com o quartzo mineral tenha um teor de silício de até 46,7%).
Desde silicone encontrados na natureza também num elegante, isto é, a forma elementar, que é reconhecido pela Associação Internacional mineralógica (IMA) como um mineral, e é na classificação mineral Strunz'schen (9 ed.) Do número do sistema. 1.CB.15 (8 edição: I / B.05-10) liderou no departamento de semi-metais e não-metais. No mais conhecido na classificação de língua inglesa de minerais de acordo com Dana, o elemento mineral carrega o sistema não. 01.03.07.01.
Silício sólido foi detectado (2011) nos sites da 15, incluindo pela primeira vez no depósito de Nuevo Potosí em Cuba. Outras localidades estão na República Popular da China, Rússia, Turquia e Estados Unidos.
Silicatkreislauf
Os minerais silicáticos são permanentemente degradados pela reação com o ácido carbônico da água para formar o ácido metassilícico e os carbonatos, como mostra o exemplo do silicato de cálcio:
O ácido metassilícico insolúvel reage ainda com ácido carbônico para formar ácido ortossilícico solúvel:
No entanto, o ácido ortossilícico reage consigo mesmo de forma relativamente rápida para formar dióxido de silício (amorfo) e água, desde que o valor de pH seja ≥ 3. A concentração absoluta de ácido ortossilícico é relativamente baixa (por exemplo, <aprox. 7 mmol na água do mar).
Pela incorporação de silica ou de água silicatos solúveis em organismos marinhos (. 1) que sedimento após a morte para o fundo do mar, ou por actividade vulcânica e saída de magma no fundo do mar, os minerais de silicatos são devolvidos formado (2.), E o circuito é fechado:
O horizonte de tempo em que esse processo ocorre é de vários milhões de anos, por isso é consideravelmente mais longo do que no caso do ciclo de carbono da natureza viva.
Silício na natureza viva
Além da já mencionada natureza essencial do silício, existem vários organismos que produzem estruturas contendo dióxido de silício. os (diatomáceas), esponjas (Porifera, Spongiaria) e Radiolarien o melhor conhecido construir um exoesqueleto de dióxido de silício, que é caracterizada por condensação catalisada por enzima de ácido silícico orto Si (OH) 4. Muitas plantas também contêm sílica em seus caules e folhas. Exemplos bem conhecidos aqui são o rabo de cavalo e a planta de bambu. O backbone de sílica acumulado lhes dá estabilidade adicional.
Significado fisiológico para humanos
O silício parece ser necessário para a formação e maturação óssea. Em bezerros, a administração de ortossilicato levou à proliferação de colágeno na pele e cartilagem. A ingestão desejável derivada de experiências com animais é 30 mg / d. Deficiências em humanos ainda não são conhecidas.
Sílica ou sílica terra são produtos orais. Essencialmente, eles contêm anidridos silícicos (dióxido de silício) e dizem fortalecer a pele, unhas, ossos e tecido conjuntivo e mantê-los saudáveis. Um efeito não foi cientificamente comprovado.
Um excesso de silício pode causar hemólise dos eritrócitos e, como consequência direta, alterações celulares.
Extração no laboratório
O silício elementar pode ser obtido em escala laboratorial por redução, a partir de sílica ou tetrafluoreto de silício, com metais básicos. Reação 2.) É um processo aluminotérmico, que funciona apenas com adição de enxofre elementar, a terceira rota corresponde à descoberta do elemento:
O silício amorfo altamente reativo pode ser obtido por redução com sódio ou acidólise de silicietos:
Extração na indústria
O silício elementar é utilizado em diferentes graus de pureza em metalurgia (ferrossilício), fotovoltaica (células solares) e em microeletrônica (semicondutores, chips de computador). Assim, é comum na indústria classificar o silício elementar com base em diferentes graus de pureza. Uma distinção SIMG (grau metalúrgico,-silício de grau metalúrgico, 98-99% de pureza), SISG (grau solar, de silício solar, impurezas menores 0,01%) e Win (grau electrónico, de silício de semicondutores, impurezas menores 10-9). Para as células solares, a pureza do material em toda a sua espessura é importante para garantir a vida útil mais longa possível. Para muitas aplicações em microeletrônica, somente as camadas superiores de cerca de 20 a 30 microns devem ser altamente puras.
Tradicionalmente, é utilizado o processo Siemens, no qual o silício é primeiramente reagido com cloreto de hidrogênio gasoso a 300-350 ° C em um reator de leito fluidizado para triclorossilano (silicoclorofórmio).
Após várias etapas de destilação, o triclorosilano é decomposto termicamente na presença de hidrogênio em uma reversão da reação acima em hastes de silício hyperpure aquecidas a 1000-1200 ° C. O silício elementar cresce nas hastes. O cloreto de hidrogênio liberado é devolvido à circulação. Como subproduto, o tetracloreto de silício precipita, que é convertido em triclorosilano e retornado ao processo ou queimado na chama de oxigênio para a sílica pirogênica. O processo da Siemens produz 19 kg de resíduos e subprodutos por kg de silício hiperpuro.
silício em bruto
Em escala industrial, o silício elementar é obtido pela redução da sílica com carbono no forno de redução de fundição a temperaturas de cerca de 2000 ° C. O material inicial é areia de quartzo ou cascalho de quartzo.
A 2002 produziu cerca de 4,1 milhões de toneladas deste silício industrial bruto (Simg). É suficientemente limpos para fins metalúrgicos, e é usado como elemento de liga e Desoxidant para os aços (resistência melhorada à corrosão, a supressão de cementite) e como uma matéria prima para a produção de silano sobre o processo Müller-Rochow que irá eventualmente servir principalmente para a produção de silicones. Para a produção de ferrossilício para a indústria siderúrgica (desoxidante no processo de alto-forno), a reação subsequente é realizada de forma expedita na presença de ferro elementar.
Outras possibilidades de digestão do SiO2 são:
A digestão de soda a aproximadamente 1600 ° C no tanque de fusão:
A digestão hidrotérmica a aproximadamente 200 ° C com água em autoclave:
solares de silício
Para a produção de células solares, o silício bruto deve ser ainda mais purificado para silício solar (Sisg). Existem procedimentos diferentes para isso. Estes métodos são a parte mais intensiva em energia na produção de módulos solares devido aos muitos passos intermediários complexos. Portanto, vários métodos de fabricação, como o método UMG (Grade Metalúrgica Atualizada) e o método FBR (reator de leito fluidizado) estão sendo testados e usados.
Uma alternativa isenta de cloro é a decomposição de monossilano, que se decompõe novamente após um passo de limpeza em superfícies aquecidas ou quando passa por reatores de leito fluidizado.
O silício policristalino (polissilício) obtido destas formas é adequado para a produção de módulos solares e tem uma pureza de mais de 99,99%. Na tecnologia solar, como na microeletrônica, as propriedades semicondutoras do silício são exploradas.
Apenas de interesse histórico é um procedimento que foi utilizado anteriormente pela empresa DuPont. Baseou-se na redução do tetraclorossilano com vapor de zinco elementar a temperaturas de 950 ° C.
Devido a problemas técnicos e à grande quantidade de resíduos de cloreto de zinco, este processo não é mais usado hoje.
silício Semiconductor
Silício semicondutor monocristalino
Para aplicações em microeletrônica, é necessário silício monocristalino de alta pureza (Sieg). Em particular, as contaminações com elementos que também são adequados como elementos de dopagem devem ser levados a concentrações abaixo de certos valores críticos por meio de tração de cadinho ou fusão da zona. O fabricante Shin-Etsu anuncia um "11N" -ref (= 99,999 999 999%) dos seus lingotes.
No estiramento do cadinho (processo de Czochralski), o silício solar obtido no processo da Siemens é fundido em cadinhos de quartzo. Um cristal de semente de silício monocristalino de alta pureza é colocado neste fundido e lentamente retirado do fundido enquanto gira para cristalizar silício de alta pureza em forma monocristalina no cristal deixando quase todos os contaminantes no fundido. A base física deste processo de purificação é a depressão do ponto de fusão e a tendência das substâncias para cristalizar tão puro quanto possível.
Alternativamente, durante a fusão da zona com o auxílio de um aquecedor de indução elétrico (em forma de anel), uma zona fundida é passada através de uma haste de silício, pelo que uma grande parte dos contaminantes se dissolve no fundido e migra com ele.
O silício cristalino de alta pureza é atualmente o material de base mais adequado para microeletrônica; menos no que diz respeito às suas propriedades elétricas do que devido às propriedades químicas, físicas e técnicas do silício e seus compostos (dióxido de silício, nitreto de silício, etc.). Todos os chips de computador comuns, memória, transistores, etc. usam silício de alta pureza como material de partida. Essas aplicações são baseadas no fato de que o silício é um semicondutor. Através da incorporação direcionada de impurezas (doping), como índio, antimônio, arsênico, boro ou fósforo, as propriedades elétricas do silício podem variar dentro de uma ampla faixa. Acima de tudo, por meio dos efeitos de junção PN assim gerados, pode-se realizar uma variedade de circuitos eletrônicos. Por causa da crescente importância dos circuitos eletrônicos, também se fala da idade do silício. O nome do Vale do Silício para a região de alta tecnologia na Califórnia também aponta para a enorme importância do silício nas indústrias de semicondutores e computadores.
O silício amorfo pode ser convertido em silício policristalino usando lasers excimer. Isso é de importância crescente para a fabricação de transistores de película fina (TFT) para telas planas.
wafer de silício
O silício está comercialmente disponível tanto como um pó de grão fino como em peças maiores. O silício de alta pureza para uso em módulos solares ou em componentes semicondutores é geralmente produzido na forma de discos finos de cristais simples, os chamados wafers de silício (veja a Fig.). Devido ao alto investimento inicial e aos longos prazos de construção dos fornos necessários, apenas algumas empresas no mundo produzem silício bruto.
Os maiores produtores de silício metalúrgico são:
- Elkem (N, EUA)
- Invensil (F, EUA)
- Globo Metalúrgico (EUA)
- Rima Metal (Br)
Existem sobre 15 outros grandes produtores. Há uma série de trabalhos menores na República Popular da China, tornando-se o maior produtor do país.
O mercado de silício polissilício e hiperpuro está em transição desde o meio dos 2000s. Devido à alta demanda da indústria solar, a 2006 chegou a uma escassez de silício.
Propriedades físicas
O silício, como o germânio, o gálio, o fósforo e o antimônio adjacentes à Tabela Periódica, é um semicondutor elementar. A distância energética entre a banda de valência e a banda de condução, de acordo com o modelo da banda, é 1,107 eV (à temperatura ambiente). Dopando com elementos de dopagem adequados, como boro ou arsênico, a condutividade pode ser aumentada por um fator 106. Em silício dopado dessa maneira, a linha de impurezas causada por impurezas e defeitos de treliça é significativamente maior do que a da linha intrínseca, razão pela qual esses materiais são chamados de semicondutores de impureza. O parâmetro da grade é 543 pm.
Espectro do índice de refração complexo (N = n + ik) de silício
O índice de refração complexo, que depende do comprimento de onda da luz, é mostrado na imagem ao lado. Também aqui podem ser lidas informações sobre a estrutura da banda. O curso fortemente crescente do coeficiente de extinção k mostra uma transição de banda direta em 370 nm (E1 = 3,4 eV). Outra transição direta de banda pode ser observada em ≈ 300 nm (EΓ2 = 4,2 eV). A transição de banda indireta do silício (Eg = 1,1 eV) só pode ser adivinhada. O fato de que existem transições de banda indiretas adicionais pode ser visto na curva ampla de k para comprimentos de onda> 400 nm.
Tal como a água e algumas outras substâncias, o silício tem uma anomalia de densidade: a sua densidade na forma líquida (a Tm = 1685 K) é superior em 10-11% do que na forma sólida, cristalina (c-Si) por 300 K.
Propriedades químicas
Em todos os que ocorrem na natureza e na grande maioria dos compostos produzidos sinteticamente, o silício forma exclusivamente ligações simples. A estabilidade da ligação simples Si-O, em contraste com a dupla ligação CO, é devida ao seu caráter parcial de dupla ligação, que resulta da sobreposição dos pares isolados de oxigênio com os orbitais d vazios de silício. A regra das ligações duplas, que há muito tempo é considerada válida, segundo a qual o silício é um elemento do 3. No entanto, entretanto, tornou-se obsoleto uma vez que um grande número de compostos produzidos sinteticamente com ligações duplas de Si-Si são agora conhecidos. Em 2004, o primeiro composto com uma ligação tripla formal Si-Si foi estruturalmente caracterizado.
Com exceção do ácido fluorídrico contendo ácido nítrico (no qual o hexafluorossilicato é formado), o silício é insolúvel em ácidos porque a passivação ocorre através da formação de uma camada de sílica sólida. Por outro lado, dissolve-se facilmente em álcalis cáusticos quentes com a formação de hidrogênio. Apesar de seu potencial normal negativo (-0,81 V), é relativamente inerte em sua forma compacta, pois cobre-se com uma camada protetora de óxido no ar.
Propriedades mecânicas
As propriedades mecânicas do silício são anisotrópicas (direcional). Dependendo da orientação do cristal selecionado, o módulo de elasticidade assume valores entre 130 GPa e 189 GPa. Uma descrição geral do comportamento elástico é dada na notação de Voigt como para todos os cristais cúbicos através das três constantes elásticas independentes C11, C12 e C44. A matriz de elasticidade é para silício:
As constantes elásticas possuem os seguintes valores:
Os respectivos módulos elásticos podem ser calculados a partir das constantes elásticas para as direções dos cristais principais individuais do silício (100,110 e 111):
isótopo
Há um total de isótopos 23 entre 22Si e 45Si de silício conhecido. Destes, três, os isótopos 28Si, 29Si e 30Si, são estáveis e ocorrem naturalmente. O isótopo com a maior parte da composição isotópica natural é 28Si com 92,223%, 29Si tem uma participação de 4,685% e 30Si de 3,092%. Os isótopos instáveis de vida mais longa são 32Si que se funde com uma meia-vida de 153 anos sob o decaimento beta em 32P (fósforo) e 31Si, que decai com uma meia-vida de minutos 157,36 também sob o decaimento beta para 31P. Todos os outros isótopos têm apenas meias-vidas curtas de segundos ou milissegundos.
28Si é formado em estrelas pesadas no final do seu desenvolvimento em grandes quantidades (queima de oxigênio). Esta é a razão para a alta proporção de 28Si no silício total (92,23%) e também na freqüência de silício em comparação com outros elementos. Desde o 2009, tentativas foram feitas para redefinir o quilograma da unidade de base do SI como um dado conjunto de átomos 28Si; Essas tentativas levaram o 2018 a uma nova definição em novembro. Também estáveis são os isótopos 29Si (4,67% do total de silício) e 30Si (3,1%).
O isótopo radioativo 31Si decai rapidamente (meia-vida 157,3 minutos) pela radiação beta para fósforo estável. Esta circunstância pode ser usada para produzir silício muito homogeneamente dopado com n. Para este efeito, o silício é irradiado com nêutrons, por captura de nêutrons, em seguida, surge 31Si e, assim, 31P. Uma fonte de nêutrons adequada para este método é a fonte de pesquisa de neutrons Heinz Maier-Leibnitz. Mais durável é o 32Si com uma meia-vida de 172 anos. Traços desse isótopo são formados na atmosfera da Terra pela espalação de argônio pela radiação cósmica. 32Si decai para o 32P igualmente radioativo (14,3 dias de meia vida), e depois para 32S estável (enxofre). Todos os outros isótopos se desintegram em poucos segundos.
Segurança
O silício é um pó combustível como muitos elementos. Como um pó e grânulos é irritante. O silício compacto é inofensivo.
O silício poroso hidrogenado, ou seja, superficialmente coberto por hidrogênio, pode ser altamente explosivo sob irradiação a laser e um aumento de oxigênio, como descobriram por acaso pesquisadores da Universidade Técnica de Munique. Jateamento na faixa do micrômetro é possível. A velocidade de detonação e a energia de detonação são maiores do que para TNT e dinamite.
Uso na tecnologia
1947 descobriu John Bardeen, Walter Brattain e William Shockley a resistência elétrica controlável, o transistor, primeiro em um único cristal de germânio. O silício de conexão alegre poderia ser isolado somente mais tarde na pureza necessária para propósitos eletrônicos. 1958 Robert Noyce da Fairchild e Jack S. Kilby da Texas Instruments desenvolveram independentemente o circuito integrado (IC) em um chip de silício. Desde cerca de 1970, o silício é o material básico da maioria dos produtos semicondutores e é o material de base para muitos sensores e outros sistemas micromecânicos (por exemplo, braço de alavanca em um microscópio de força atômica). O silício é também o componente elementar da maioria das células solares.
Em novembro, 2005 foi relatado nos primeiros resultados promissores com lasers de silício.
O silício é usado como combustível de alta energia em muitos explosivos.
Como o silício se expande após a solidificação, enquanto a maioria das substâncias contrai, ele é adicionado a muitas ligas fundidas. Por exemplo, o ferro fundido contém sempre cerca de 2% Si. De particular importância são as ligas de alumínio-silício nas quais o teor de Si pode ser de até 20%. Esta é a variedade mais importante de todos os materiais de alumínio fundido.
Conexões
O silício é quase sempre tetravalente em compostos químicos. Por conseguinte, o átomo de silício nos compostos é geralmente de quatro coordenadas. Além disso, existem agora vários compostos nos quais o silício tem uma coordenação de cinco ou seis vezes. Além do silício tetravalente e compostos sinteticamente preparados de silício divalente (silílicos) são conhecidos, mas a maioria é muito instável. De maior importância é apenas o monóxido de silício, que é usado como material para a compensação de lentes ópticas. Além disso, 2012 também detectou experimentalmente um composto de três coordenadas semelhante à estrutura unidimensional do grafeno, o chamado siliceno.
Toda a química do silício é essencialmente caracterizada pela alta afinidade do silício pelo oxigênio. O silício é geralmente o parceiro eletropositivo de um composto químico, embora também haja compostos com silício formalmente negado. Estes são principalmente silicidas, onde o silício também pode formar aniões verdadeiros.
![]()
Inversão de polaridade de ligação
Particularmente notável é a inversão da polaridade de ligação das ligações elemento-hidrogênio na transição de carbono para silício. Aqui, a diferença de eletronegatividade muda de + 0,45 (carbono-hidrogênio) para -0,2, e é por isso que os compostos de silano têm uma reatividade completamente diferente dos hidrocarbonetos.
Os compostos mais importantes do silício podem ser divididos nas seguintes classes, das quais alguns representantes são mencionados:
Conexões binárias
- carboneto de silício
- sílica
- nitreto de silício
- silicietos
silicato
- Zircão e todos os outros silicatos e compostos de ácido silícico
halogenetos de silício
- tetrafluoreto de silício
- tetracloreto de silício
- Triclorossilano (silicoclorofórmio)
hidretos de silício
- monosilano
- Silano
Compostos orgânicos de silício
- Tetrametilsilano (TMS, padrão NMR)
- Metilclorossilanos tais como diclorometilsilano (blocos de construção para silicones)
- phenylchlorosilane
- carbosilanes
- Carbosilazane
- carbosiloxanes
Compostos poliméricos de silício
- Os silicones (silicones, poliorganossiloxanos) são formados por polimerização e pertencem aos plásticos industriais mais importantes.
- Compostos poliméricos de silício-oxigênio são aplicados em muitas áreas; Eles servem como lubrificantes e selantes nas indústrias de cosméticos e construção.
- Polisilanos, -carbossilanos, -carbossilazanos, -carbossiloxanos
outro
Até hoje, é comum que a palavra em inglês "silicon" (para silício) seja falsamente traduzida ou pronunciada em artigos de ciência popular ou em dublagem de filmes como "silicone" ("silicone"). Isso aconteceu, por exemplo, na série de ficção científica Star Trek, o thriller do agente de James Bond em face da morte ou na série animada Os Simpsons. Exemplo: "A forma de vida é feita de carbono ou silicone?"
Preços do silício
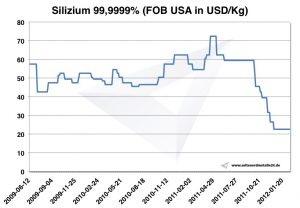
Silício gráfico 2009-2012





















