Zircônio, Zr, número atômico 40
Preço de zircônio, ocorrência, extração e uso
Zircônio, muitas vezes também zircônio, é um elemento químico com o símbolo do elemento Zr e o número ordinal 40. Seu nome deriva do zircão, o mineral de zircônio mais comum. Na tabela periódica está no 5. período; é o segundo elemento do 4. Grupo (subgrupo 4 obsoleto) ou grupo titan. O zircónio é um metal pesado muito resistente à corrosão. Funções biológicas são desconhecidas; está presente em pequenas quantidades (4 mg / kg) no organismo humano e não é tóxico.
O importante mineral contendo zircônio zircão (Zr [SiO4]) é conhecida como gema desde os tempos antigos. O zircônio como elemento foi descoberto por Martin Heinrich Klaproth em 1789 em uma amostra do mineral zircão do Ceilão e recebeu seu nome. O metal foi apresentado pela primeira vez em 1824 por Jöns Jakob Berzelius através de uma redução de K.2ZRF6 com potássio. Para fazer isso, ele aqueceu "Uma mistura de potássio de zircônio fluorídrico com potássio em um tubo de ferro". Após tratamento com água, secagem e aquecimento prolongado com ácido clorídrico diluído, Berzelius recebeu um "Pó fumoso que parece preto de carvão" foi e só "Apertando com o aço de polimento uma cor cinza escuro e brilho" recebido. A massa atômica correta, por outro lado, não pôde ser determinada até 1924 porque - além dos erros na execução dos experimentos - não se sabia que o zircônio sempre contém pequenas quantidades de háfnio. Sem essa informação, as medições sempre deram uma massa atômica um pouco alta demais. A primeira aplicação prática do zircônio foi como um pó de flash sem fumaça.
ocorrência
O zircónio ocorre na crosta terrestre com um teor de cerca de 0,016%. Na lista de elementos ordenada por freqüência, o zircônio está no 18. Coloque e seja mais comum que os elementos mais familiares do cloro e do cobre. Embora seja muito difundido, geralmente é encontrado apenas em quantidades muito pequenas e em cristais muito pequenos (tipicamente em torno de 0,1 mm). Portanto, o zircônio tem sido considerado raro nos tempos antigos. O zircônio é encontrado principalmente em rochas intrusivas de silicato, como o granito. Não vem digno, mas apenas em alguns minerais, especialmente como zircão (ZrSiO4) e Baddeleyit (ZrO2) e o mais raro eudialyte vermelho (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2). Está quase sempre associado ao háfnio. Devido ao seu alto ponto de fusão de 2550 ° C, sua alta dureza e baixa reatividade, o zircônio é o mineral mais antigo que pode ser encontrado na Terra e pode ser usado para determinações de idade radiométrica baseadas em isótopos de urânio e tório.
Os depósitos secundários, os chamados depósitos de sabão, são geralmente usados como matéria-prima. Eles ocorrem quando a rocha circundante é desgastada e apenas o zircão particularmente resistente às intempéries permanece. Outros depósitos semelhantes podem surgir de correntes de água que lavam os cristais de zircônio e os levam para outros lugares. Os depósitos primários, por outro lado, geralmente têm um teor de zircônio muito baixo para uma mineração lucrativa.

Desenvolvimento temporal da promoção de zircão
Os depósitos de zircônio mais importantes estão na Austrália, nos EUA e no Brasil. Com reservas recuperáveis de 38 milhões de toneladas, a produção anual mundial de minerais de zircônio 2006 foi de 920.000 toneladas (calculada como zircônio). Destes, apenas cerca de 5% são processados em metal e ligas. Os principais países produtores foram a 2006, de longe, a Austrália e a África do Sul.
Extração e apresentação
O zircônio, a matéria-prima de zircônio mais comum, deve primeiro ser convertido em dióxido de zircônio antes de continuar o processamento. Para isso, o zircão é fervido em um hidróxido de sódio (digestão alcalina). A zircônia é então reagida com coque no arco para formar carbonitreto de zircônio (zircônio contendo carbono e nitrogênio) e depois com cloro para formar o tetracloreto de zircônio.

A redução direta do dióxido de zircônio com carbono (como no processo de alto-forno) não é possível, uma vez que os carbonetos formados são muito difíceis de separar do metal. Em vez disso, o tetracloreto de zircônio é reduzido a zircônio metálico no chamado processo Kroll com magnésio em uma atmosfera de hélio.

O processo Van-Arkel-de-Boer é usado para obter zircônio mais puro. Durante o aquecimento sob vácuo, o zircônio inicialmente reage com o iodo para formar iodeto de zircônio (IV). Este é dividido novamente em zircônio e iodo em um fio quente:

O tetraiodeto de zircônio se forma a partir do zircônio e do iodo a 200 ° C; ele se desintegra novamente a 1300 ° C.
O zircônio e o háfnio não podem ser separados de maneira química simples. Portanto, mesmo este zircônio de alta pureza ainda contém háfnio. Como é importante para muitas aplicações na tecnologia de reatores que o zircônio não contenha hafnium, os processos de separação desses dois metais desempenham um papel importante. Uma possibilidade são os métodos de extração nos quais a diferente solubilidade dos compostos de zircônio e háfnio em solventes especiais é explorada. Freqüentemente, os tiocianatos e suas diferentes solubilidades na metil-isobutil-cetona são explorados. Outras possibilidades são os permutadores de iões ou a destilação fraccionada de compostos adequados.
Propriedades
Propriedades físicas

Estrutura cristalina do α-zircônio
O zircónio é um metal pesado prateado brilhante (densidade 6,501 g / cm3 a 25 ° C), assemelha-se externamente ao aço. O metal cristaliza em duas modificações diferentes nas quais pode ser convertido por mudança de temperatura. Abaixo de 870 ° C cristaliza α-zircônio no sistema de cristal hexagonal (embalagem de esfera hexagonal-densa, tipo magnésio) no grupo espacial 6/ mmm com os parâmetros de grade a = 323 pm e c = 514 pm, bem como duas unidades de fórmula por célula unitária. Em 870 ° C, a estrutura cristalina muda para a estrutura β centrada no cubo (tipo tungstênio) com o grupo de espaço  e o parâmetro de rede a = 361 pm.
e o parâmetro de rede a = 361 pm.
O zircónio é relativamente macio e flexível. Pode ser facilmente processado rolando, forjando e martelando. No entanto, torna-se quebradiço e difícil de processar devido aos baixos níveis de contaminação por hidrogênio, carbono ou nitrogênio no metal. A condutividade elétrica não é tão boa quanto a de outros metais. É apenas cerca de 4% do cobre. Em contraste, o zircônio é um bom condutor de calor. O ponto de fusão e o ponto de ebulição são ligeiramente superiores em comparação com o homólogo de titânio mais leve (ponto de fusão: titânio: 1667 ° C, zircónio: 1857 ° C). Além disso, a condutividade elétrica e térmica é melhor. Abaixo de 0,55 K, o zircônio se torna supercondutor.
As propriedades do zircônio e do háfnio homólogo mais pesado são muito semelhantes devido à contração dos lantanídeos. Isso requer raios atômicos semelhantes (Zr: 159 pm, Hf: 156 pm) e, portanto, propriedades semelhantes. Os dois metais diferem consideravelmente em sua densidade (Zr: 6,5 g / cm3, Hf: 13,3 g / cm3).
Uma propriedade importante, por causa da qual o zircônio ganhou grande importância na construção de reatores, é sua pequena seção transversal de captura de nêutrons. Nessa propriedade, o zircônio também é muito diferente do háfnio. Isso torna o processo de separação complexo necessário para essas aplicações.
Propriedades químicas
O zircônio é um metal básico que reage com muitos não metais, especialmente em altas temperaturas. Principalmente como um pó, ele queima com uma chama branca para formar dióxido de zircônio e, na presença de nitrogênio, também para formar nitreto de zircônio e oxinitreto de zircônio. O metal compacto só reage com o oxigênio e o nitrogênio quando é calor branco. Sob pressão aumentada, o zircônio reage com o oxigênio mesmo em temperatura ambiente, uma vez que o óxido de zircônio formado é solúvel no metal fundido.
O zircônio é passivado no ar por uma camada fina e muito densa de óxido de zircônio e, portanto, é inerte. É, portanto, insolúvel em quase todos os ácidos, apenas a água régia e o ácido fluorídrico atacam o zircônio à temperatura ambiente. As bases aquosas não reagem com o zircônio.
isótopo
Existem muitos isótopos de zircônio entre 78Zr e 110Zr conhecido. O zircônio natural é um elemento misto que consiste em cinco isótopos. Estes são 90Zr, que ocorre com mais frequência com uma participação de 51,45% do zircônio natural, assim como os isótopos mais pesados 91Zr (11,32%), 92Zr (17,19%), 94Zr (17,28%) e 96Zr com 2,76% de participação. 96Zr é o único isótopo natural que é fracamente radioativo; ele decai com meia-vida de 2418 Anos sob decomposição beta dupla 96Mo. O isótopo 91Zr pode ser detectado com o auxílio de espectroscopia de NMR.
Usar
 Um uso importante do zircônio são as conchas de células de combustível de urânio da Zircaloy em usinas nucleares. Esta liga consiste em aproximadamente 90% de zircônio e pequenas quantidades de estanho, ferro, cromo ou níquel, mas não deve conter háfnio. A razão para a escolha deste elemento é a seção transversal de baixa captura já descrita para nêutrons térmicos com alta resistência à corrosão, o que o torna adequado como material de construção para fábricas de produtos químicos, especialmente para peças de aparelhos especiais, como válvulas, bombas, tubos e trocadores de calor. Como uma adição de liga ao aço, também aumenta a resistência à corrosão. Os instrumentos cirúrgicos são fabricados com ligas apropriadas.
Um uso importante do zircônio são as conchas de células de combustível de urânio da Zircaloy em usinas nucleares. Esta liga consiste em aproximadamente 90% de zircônio e pequenas quantidades de estanho, ferro, cromo ou níquel, mas não deve conter háfnio. A razão para a escolha deste elemento é a seção transversal de baixa captura já descrita para nêutrons térmicos com alta resistência à corrosão, o que o torna adequado como material de construção para fábricas de produtos químicos, especialmente para peças de aparelhos especiais, como válvulas, bombas, tubos e trocadores de calor. Como uma adição de liga ao aço, também aumenta a resistência à corrosão. Os instrumentos cirúrgicos são fabricados com ligas apropriadas.
Como o zircônio reage com pequenas quantidades de oxigênio e nitrogênio, ele pode ser usado como material absorvente em lâmpadas incandescentes e sistemas de vácuo para manter o vácuo. Essa propriedade também é usada na metalurgia para remover oxigênio, nitrogênio e enxofre do aço.
Devido à sua capacidade de emitir uma luz muito brilhante quando queimada, foi usada além do magnésio como um pó instantâneo. Ao contrário do magnésio, o zircônio tem a vantagem de não fumar. Esse recurso também é explorado em fogos de artifício e luzes de sinalização.
O zircônio emite uma onda de faíscas quando atinge as superfícies metálicas e é inflamável. Os militares usam isso em alguns tipos de munição, como a munição especial de espingarda Dragon's Breath e a bomba planadora americana AGM-154 JSOW. Na tecnologia de filme, esse efeito é usado para efeitos de impacto não pirotécnico de, por exemplo, balas em superfícies de metal.
As ligas de zircônio-nióbio são supercondutoras e permanecem assim mesmo quando fortes campos magnéticos são aplicados. Portanto, eles são usados para ímãs supercondutores.
Além de alúmen contendo alumínio, sais de zircônio são usados no “curtimento branco” de peles.
segurança
Não se conhecem efeitos tóxicos do zircônio e de seus compostos. Devido à densa camada de óxido, o zircônio compacto não é inflamável. Em forma de pó, por outro lado, pode começar a queimar quando aquecido ao ar. Os incêndios com zircônio são muito perigosos, pois não podem ser usados para extinguir água (reação vigorosa com a formação de hidrogênio), nem dióxido de carbono ou halon. Os fogos de zircônio devem ser extintos com extintores de metal (classe D) ou areia seca.
prova
Com o Alizarin Red-S, o ácido de zircônio forma um composto vermelho-violeta característico (lago colorido), que desaparece com a adição de íons fluoreto para formar o complexo de zircônio-flúor. Essa reação pode servir como detecção qualitativa de zircônio e flúor. Como até pequenas quantidades de fluoreto (e outros ânions) interferem, essa detecção não é adequada para análises minerais. Além disso, alguns outros compostos orgânicos, como tanino, Kupferron, ácido fenilarsônico, oxina ou xilenol laranja, são adequados como reagente de detecção. Outro composto característico é o cloreto de zircônio ZrOCl2 · 8 H2O, que cristaliza em agulhas típicas. Na análise moderna, o zircônio pode ser detectado por espectrometria de absorção atômica (AAS) ou espectrometria de massa (também pelo padrão isotópico).
Uma possibilidade para análise quantitativa é a precipitação de hidróxido de zircônio moderadamente solúvel com amônia e posterior calcinação em zircônia.

- Precipitação do hidróxido
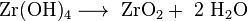
- Transferir para o molde de pesagem
Conexões
Como um metal básico, o zircônio forma uma infinidade de compostos. A maioria dos compostos de zircônio são sais. Eles geralmente são muito estáveis e têm um alto ponto de fusão. O estado de oxidação + IV é o preferido e o mais estável. Mas também existem compostos nos estados de oxidação + III a + I, e em complexos até mesmo nos estados 0, −I e −II.
zircônia
 O composto de zircônio mais importante é o dióxido de zircônio ZrO2, um óxido muito estável e refratário. O dióxido de zircônio é usado para produzir revestimentos refratários em cadinhos e fornos. Para usá-lo, no entanto, ele deve ser estabilizado com cálcio, ítria ou magnésia para estabilizar a fase cúbica de alta temperatura. Além disso, é usado como abrasivo e, devido à cor branca, como pigmento branco para porcelana.
O composto de zircônio mais importante é o dióxido de zircônio ZrO2, um óxido muito estável e refratário. O dióxido de zircônio é usado para produzir revestimentos refratários em cadinhos e fornos. Para usá-lo, no entanto, ele deve ser estabilizado com cálcio, ítria ou magnésia para estabilizar a fase cúbica de alta temperatura. Além disso, é usado como abrasivo e, devido à cor branca, como pigmento branco para porcelana.
Os cristais de dióxido de zircônio são incolores e têm um alto índice de refração. É por isso que eles são usados com o nome de zircônia como uma pedra preciosa artificial e substituto de diamantes.
Se o óxido de zircônio for misturado com o óxido de ítrio, surgem outras possibilidades de aplicação. Com teor de óxido de ítrio de três por cento, o ZrO2 estabilizado em uma estrutura distorcida de fluorita. Como resultado, atua como condutor de íons de oxigênio a temperaturas acima de 300 ° C. Uma aplicação importante para isso é a sonda Lambda em carros, usada para medir o conteúdo de oxigênio nos gases de escape do catalisador. Com um teor de% de Ítria% 15, a zircônia emite uma luz branca muito brilhante a 1000 ° C. Isso é usado na chamada aplicação da lâmpada Nernst. Como as cerâmicas de ítrio-zircônio têm uma tenacidade à fratura extremamente alta, elas são usadas, por exemplo, na odontologia como uma estrutura de ponte e ponte altamente estável, em articulações artificiais do quadril e implantes dentários ou como elemento de conexão em telescópios. No processo, eles estão substituindo cada vez mais ouro e outros metais em suas funções.
O óxido de zircônio também é freqüentemente usado para rolamentos de esferas. Especialmente para as pistas de rolamento, ZrO2 a grande vantagem de que o coeficiente de dilatação térmica é próximo ao do aço. Outras cerâmicas técnicas, como o nitreto de silício, geralmente têm um coeficiente de expansão térmica consideravelmente mais baixo.
halogenetos
O zircônio forma várias séries de compostos com os halogênios flúor, cloro, bromo e iodo. Todos os halogênios são compostos da forma ZrX4ZrX3 e ZrX2 conhecido. Além disso, existem os cloretos, brometos e iodetos da forma ZrX. Os tetrahaletos da forma ZrX são os mais estáveis4, Sabe-se que nenhum dos halogenetos de zircônio possui aplicações importantes, sendo os cloretos de zircônio intermediários na preparação de zircônio puro.
Outros compostos de zircônio
Silicato de zircônio, ZrSiO4, mais conhecido pelo nome de mineral zircão, é o composto de zircônio mais comum encontrado na natureza. É a fonte mais importante de zircônio e seus compostos. O zircão também é usado como gema.
Os compostos orgânicos de zircônio são geralmente instáveis. Complexos orgânicos de zircônio, assim chamados. zirconocenos, com radicais como ciclopentadienil. Eles são tecnicamente importantes como catalisadores na polimerização de alcenos, especialmente para a produção de polipropileno. Outra aplicação de um composto orgânico de zircônio é no hydrozirconation, Esses alcenos estão usando o reagente de Schwartz Cp2ZrHCl (Cp = ciclopentadienil) convertido em álcoois ou hidrocarbonetos halogenados. Na reação de alquinos terminais com o reagente de Schwartz surgem nas ligações duplas trissubstituídas por hidrozirconação, a reação posterior com um reagente eletrofílico leva a alcenos trans-funcionalizados com alta pureza estereoquímica.
Os complexos de alumínio-zircônio podem ser usados como antitranspirante.
Hexafluoridozirconato de potássio (IV) K2ZRF6 (CAS: 16923-95-8) pode ser usado para separar o zircônio do háfnio.
O carbonato de zircônio existe como um complexo básico. É usado, entre outras coisas, na indústria de papel.
| Geral | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome, símbolo, número atômico | Zircônio, Zr, 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| série | metais de transição | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 4, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | branco prateado | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| número CAS | 7440-67-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fração de massa da concha de terra | 0,021% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| nuclear | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| massa atômica | 91,224 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico (calculado) | 155 (206) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 148 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| configuração electrónica | [Kr] 4d2 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionização | 640,1 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionização | 1270 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionização | 2218 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ionização | 3313 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fisicamente | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estado físico | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modificações | dois (α- / β-Zr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estrutura de cristal | hexagonal; cúbico> 1140 K (867 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| densidade | 6,501 g / cm3 (25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| dureza de Mohs | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | paramagnético ( = 1,1 10-4) = 1,1 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ponto de fusão | 2130 K (1857 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ponto de ebulição | 4682 K (4409 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molar | 14,02 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 590,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| calor de fusão | 16,9 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pressão de vapor | 0,00168 Pa em 2125 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| velocidade do som | 4650 (longo.), 2250 (trad.) M / s em 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade de calor específico | 270,0 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade elétrica | 2,36 · 106 A / (v · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| condutividade térmica | 22,7 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Químico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| estados de oxidação | 4, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| potencial normais | -1,553 V (ZrO2 + 4 H.+ + 4 e- → Zr + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| eletronegatividade | 1,33 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| isótopo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| propriedades de RMN | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| segurança | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Preços do zircônio
Preço do zircônio -> preços para metais estratégicos


